突破血脑屏障!Stroke Vasc Neurol:红细胞外泌体靶向抗铜死亡,为蛛网膜下腔出血治疗提供新策略
时间:2025-09-24
突破血脑屏障!Stroke Vasc Neurol:红细胞外泌体靶向抗铜死亡,为蛛网膜下腔出血治疗提供新策略
来源:100医药网 2025-09-24 13:06
这项研究不仅首次明确了铜死亡在SAH后早期脑损伤中的核心作用,更成功开发出兼具高靶向性、生物相容性及高效载药能力的RVG-RBCEVs递送系统。
脑疾病一直是威胁人类健康的 隐形杀手 ,其中蛛网膜下腔出血(SAH)因多由动脉瘤破裂引发、致死率高,且现有治疗手段难以有效改善预后,成为临床的重难点。近期,发表在Stroke Vasc Neurol上的研究Brain-targeted extracellular vesicles for anti-cuproptosis therapy in subarachnoid haemorrhage,从铜死亡这一新型细胞死亡机制入手,开发出靶向脑部的红细胞外泌体递送系统,为SAH的神经保护治疗带来突破性进展。

该研究团队首先通过基因表达数据库(GEO)挖掘SAH相关转录组数据(数据集GSE79416),并结合定量逆转录聚合酶链反应验证发现,SAH模型大鼠脑组织中36个铜死亡相关基因(CRGs)中有14个表达上调,其中LIAS(脂酰合成酶)、PLAT(组织型纤溶酶原激活剂)、LIPT2(脂酰转移酶2)三个基因的表达变化最为显著(|log₂折叠变化| 0.5且p 0.001)。基因本体(GO)注释与京都基因与基因组百科全书(KEGG)通路富集分析显示,差异表达CRGs主要富集于线粒体能量代谢(如氧化磷酸化、电子传递链组装)及铜离子稳态相关通路,其中氧化磷酸化通路的富集显著性最高。
进一步检测发现,LIAS的mRNA和蛋白水平在SAH后12-24小时达到峰值,同时脑组织铜离子浓度在24小时也显著升高;对46例SAH患者(世界神经外科医师联合会WFNS分级 V级)的脑脊液分析显示,发病3天内患者脑脊液中LIAS蛋白和铜离子水平均高于对照组,且LIAS水平与评估SAH严重程度的WFNS评分呈正相关,荧光染色还证实LIAS蛋白特异性定位于SAH模型小鼠的神经元中,提示LIAS可能成为SAH的潜在生物标志物及治疗靶点。
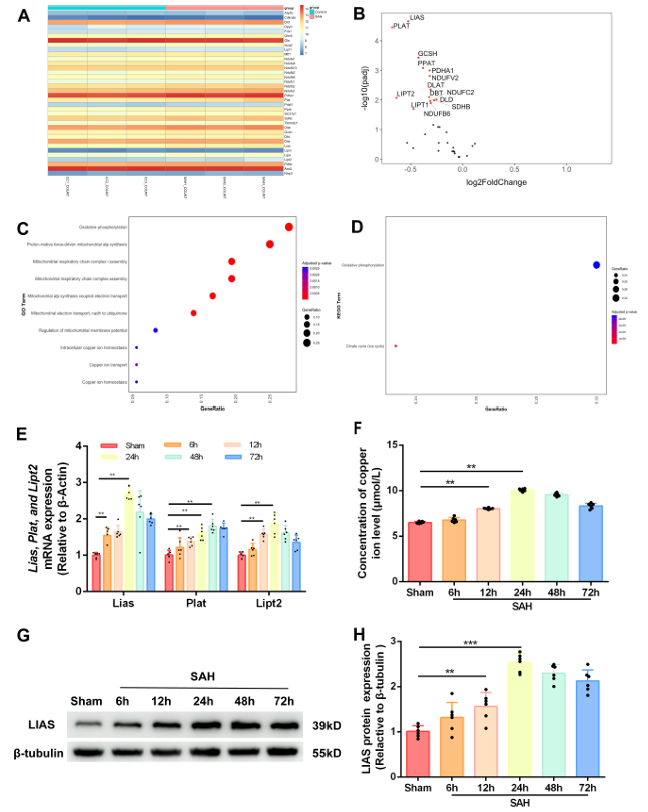
图1 蛛网膜下腔出血(SAH)中铜死亡相关基因(CRGs)的鉴定
为实现对LIAS的调控,研究团队构建了狂犬病病毒糖蛋白(RVG)修饰的红细胞外泌体(RVG-RBCEVs)作为小干扰RNA(siRNA)递送载体。通过生物正交无铜叠氮-炔环加成(点击化学)技术,将RVG29肽与红细胞外泌体(RBCEVs)表面偶联,并利用电技术(350V、150 F)将LIAS siRNA载入其中。透射电镜(TEM)、纳米颗粒追踪分析(NTA)及蛋白质印迹实验证实,RVG-RBCEVs呈球形脂质双分子层结构,平均直径约134nm(未修饰RBCEVs约86nm),表达CD63、TSG101、Alix等外泌体特征标志物及红细胞特异性血红蛋白A(HBA),而钙连蛋白(Calnexin)在红细胞(RBCs)和RBCEVs中均有表达;Cy5.5荧光标记显示,RVG修饰显著提升了外泌体向SAH小鼠脑部损伤区域的靶向富集能力,尤其能被神经元选择性摄取,而不作用于星形胶质细胞、小胶质细胞及内皮细胞。
在验证RVG-RBCEVs/siRNA的治疗效果时,研究发现该系统可显著下调SAH模型小鼠脑组织中LIAS的mRNA和蛋白表达,降低脑组织铜离子浓度,同时减少脂酰化蛋白Lip-DLAT(脂酰化二氢硫辛酸转乙酰酶)和Lip-DLST(脂酰化二氢硫辛酸琥珀酰转移酶)的积累 这些蛋白是铜离子诱导铜死亡的关键靶标。在线粒体功能保护方面,RVG-RBCEVs/siRNA处理能提高SAH小鼠脑组织中谷胱甘肽(GSH)含量、降低丙二醛(MDA)水平,改善线粒体呼吸控制率(RCR),抑制线粒体膜电位崩塌,透射电镜下可见线粒体嵴数量明显增多,表明其可有效减轻氧化应激、修复线粒体损伤。
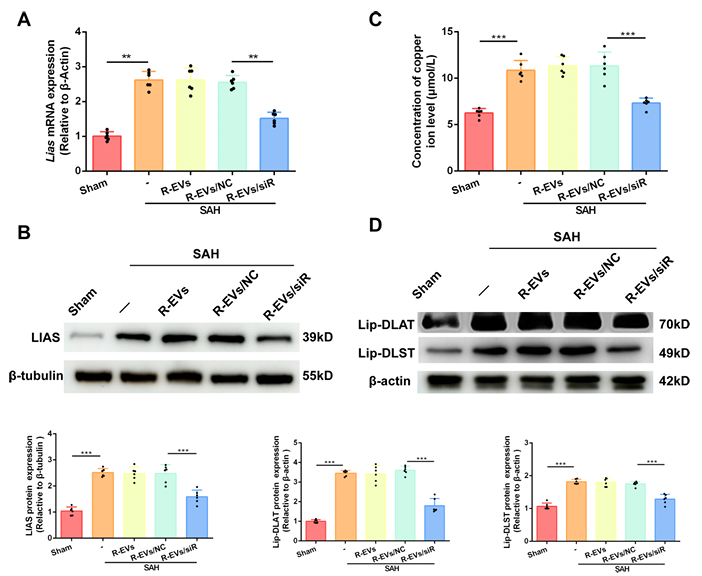
图2 RVG-RBCEVs/siRNA在体内降低铜死亡相关关键因子LIAS的表达
更为重要的是,该治疗方案展现出明确的神经保护作用。行为学评估显示,接受RVG-RBCEVs/siRNA治疗的SAH小鼠,改良Garcia评分(mGS)显著提高,烟囱试验(CT)和平衡木试验(BBT)中功能与协调能力明显改善;同时,脑组织含水量降低,伊文思蓝(Evan s blue)渗漏减少,提示血脑屏障(BBB)损伤得到缓解,Fluoro-Jade C(FJC)染色结果也证实神经元变性数量显著减少。
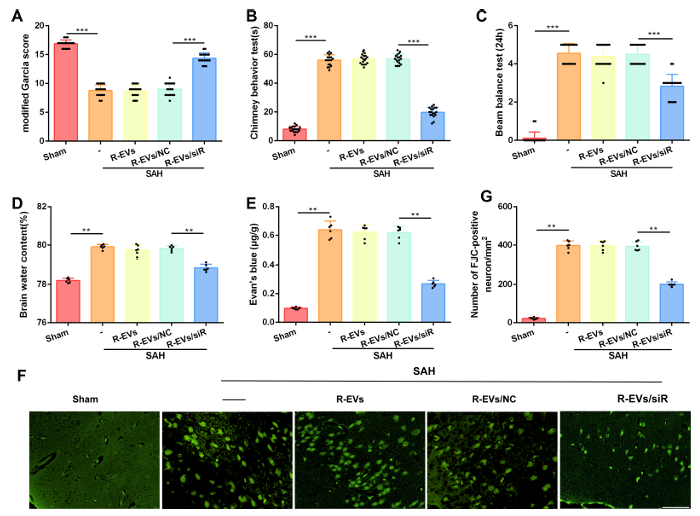
图3 RVG-RBCEVs/siRNA治疗对SAH小鼠神经保护、脑水肿、神经变性及血脑屏障破坏的影响
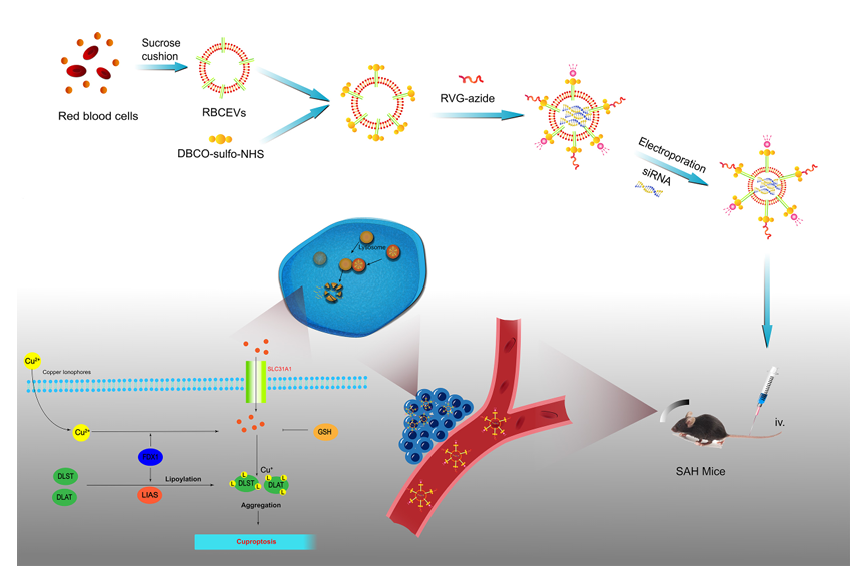
图4 RVG-RBCEVs/siRNA减轻SAH小鼠铜死亡作用的示意图
综上,这项研究不仅首次明确了铜死亡在SAH后早期脑损伤中的核心作用,更成功开发出兼具高靶向性、生物相容性及高效载药能力的RVG-RBCEVs递送系统。该系统通过抑制LIAS介导的铜死亡通路,从改善线粒体功能、减轻氧化应激、保护血脑屏障等多维度发挥神经保护作用,为SAH的治疗提供了全新的思路与潜在方案。随着该技术在临床转化中进一步优化,未来有望为更多脑患者带来福音。(100yiyao.com)
参考文献:
Xu P, Fang J, Qin F, et al. Brain-targeted extracellular vesicles for anti-cuproptosis therapy in subarachnoid haemorrhage.Stroke Vasc Neurol. Published online September 15, 2025. doi:10.1136/svn-2025-004248
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
