CR:刷新认知!浙大团队首次发现,前列腺癌细胞竟能通过表达并分泌PD-1抑制抗肿瘤免疫
时间:2025-07-26
来源:奇点糕 2025-07-26 16:25
原本应该出现在免疫细胞上的PD-1分子,竟在前列腺癌细胞上表达。这一发现为破解前列腺癌免疫治疗困局提供了全新靶点。作为全球男性第二大高发,每年夺走数十万生命。当癌症发展到晚期转移阶段,患者的生存率便会断崖式下跌。
近年来,以抗PD-1/PD-L1抗体为代表的疗法,在多种癌症中取得突破,却在"冷肿瘤"前列腺癌面前屡屡碰壁。这类肿瘤如同披着隐形斗篷,能让免疫细胞"视而不见",其背后的免疫逃逸机制始终是医学界的未解之谜。
近日,来自浙江大学医学院附属邵逸夫医院陈艺成/丁国庆/余燕岚/张杰团队,在国际肿瘤学高水平期刊《癌症研究》杂志发表一篇重要研究。他们发现原本应该出现在免疫细胞上的PD-1分子,竟在前列腺上表达。这一发现为破解前列腺癌免疫治疗困局提供了全新靶点。

研究团队分析了近百例前列腺癌临床样本,发现恶性程度越高的前列腺癌病人,癌细胞PD-1表达量越高;特别是在高Gleason评分( 8分)的患者中,癌细胞PD-1表达量是低分级患者的约3.7倍。
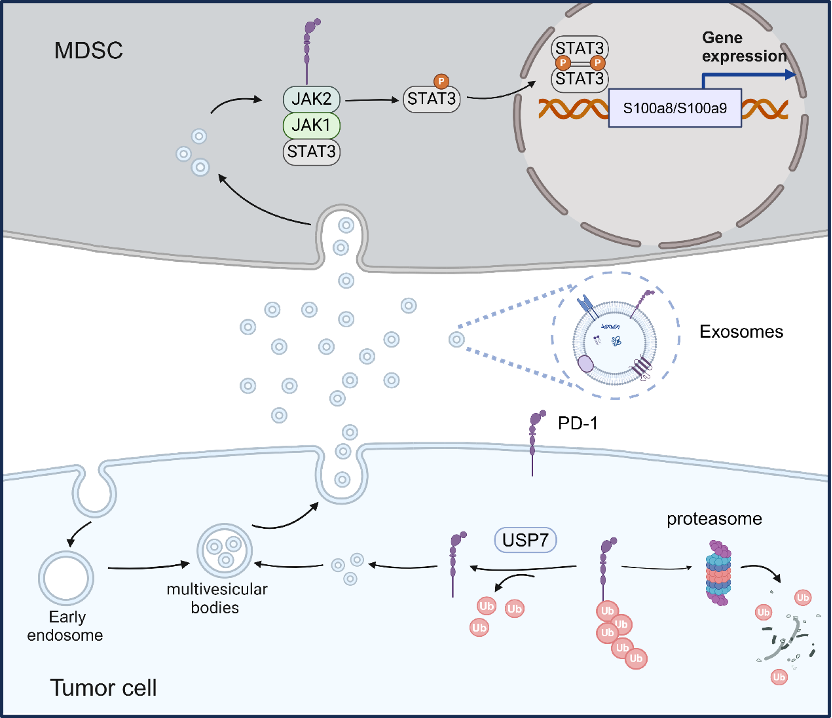
这一发现颠覆了传统认知:过去认为PD-1仅是免疫细胞的专属受体,而癌细胞竟然也能将这一免疫抑制分子转化为自身武器。
更厉害的是,这些癌细胞不仅自身高表达PD-1,还将这些分子装载到外泌体囊泡中,如同投放"生物导弹"般输送到肿瘤微环境。
浙大团队通过单细胞测序技术结合体外细胞共培养实验发现,随着携带PD-1的外泌体侵入骨髓细胞,一场精密的 策反行动 立即展开。这些携带PD-1的外泌体一旦被骨髓细胞吞噬,便激活JAK-STAT3信号通路,促使髓系来源抑制细胞(MDSC)大量扩增。肿瘤中大量活化的MDSC会形成免疫抑制性微环境,抑制对抗肿瘤的CD8+T细胞浸润。
临床数据显示,癌细胞PD-1表达越高,肿瘤微环境中CD8+T细胞数量就越少,形成强烈的"冷肿瘤"特征。机制研究发现,PD-1是通过胞内ITIM及ITSM基序激活JAK-STAT通路,而不是通过其胞外段,所以现有的抗PD-1抗体不能阻止PD-1蛋白对MDSC的活化。这也解释了PD-1抑制剂对前列腺癌患者疗效不佳的原因。
通过质谱分析,研究人员鉴定到了特异上调PD-1的去泛素化酶USP7。USP7像 分子盾牌 般保护PD-1不被降解,使其在癌细胞中稳定积累。USP7小分子抑制剂P5091促进癌细胞PD-1泛素化降解,外泌体PD-1的分泌量也随之减少。
在动物实验中,这种策略展现出惊人效果:虽然单独使用PD-1抑制剂不能抑制前列腺癌进展,但是PD-1抑制剂联用USP7抑制剂治疗后,小鼠肿瘤缩小约80%,更是有近一半的小鼠肿瘤几乎完全停止生长。免疫微环境成分分析显示,原本贫瘠的"免疫沙漠"中,CD8+T细胞数量激增3倍,而那些抑制免疫的MDSC则减少过半。
总的来说,浙江大学医学院附属邵逸夫医院团队这项研究成果表明,前列腺癌细胞中高表达的USP7维持PD-1稳定 PD-1通过外泌体释放 激活MDSC 抑制CD8+T细胞浸润。这一发现解释了"冷肿瘤"前列腺癌对免疫治疗不敏感的原因,并提出了解决策略。
目前全球正在研发的17款USP7抑制剂中,已有7款进入临床前研究阶段。这类口服小分子药物能有效穿透血前列腺屏障,与传统免疫治疗形成互补。
还有个好消息,研究团队已依托该基础研究正式启动了临床试验。最新入组数据的初步分析显示,疗效显著且安全性良好,结果令人振奋。团队期待将这一突破性成果尽早惠及患者,相关需求方可直接联系团队沟通合作。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
