Nature:神经肽SP通过细胞外ssRNA
时间:2024-10-20

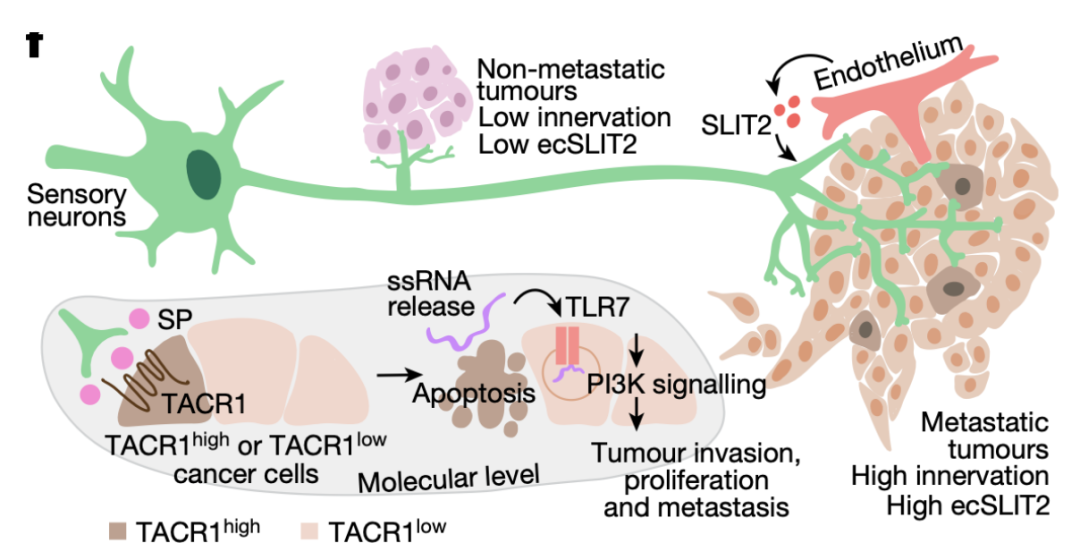
作者近期发现轴突引导分子SLIT2在转移性肿瘤的内皮中表达。与此一致的是,作者观察到,与低转移性肿瘤相比,SLIT2在高转移性乳腺肿瘤的内皮中高表达。鉴于其在轴突引导中的作用,作者,假设内皮来源的SLIT2可能调节原发性乳腺肿瘤的神经支配。为了验证这一假设,作者将4T1乳腺癌细胞原位移植到诱导敲除模型中,他莫昔芬用于驱动内皮特异性的Slit2缺失。内皮源性SLIT2缺失导致肿瘤神经支配,包括感觉神经支配明显减少,而肿瘤腔室中SLIT2的缺失并没有改变肿瘤的神经支配。这些数据表明SLIT2起源于肿瘤系统,是乳腺肿瘤神经支配的上游驱动因素。
癌细胞会沿着神经迁移,这一过程被称为神经周围浸润,需要细胞之间直接接触。然而,在三维共培养模型中,作者没有检测到神经元和癌细胞之间的物理相互作用。因此,作者假设DRG神经元可能通过分泌分子介导促转移作用。为了验证这一点,作者从肿瘤- DRG共培养体系中收集培养基(DRG-CM)。与肿瘤纯培养基相比,DRG-CM可以诱导DRG神经元的侵袭和增殖。DRG神经元所分泌神经肽包括CGRP, 神经肽P物质(SP)和galanin,作者发现SP可以促进乳腺肿瘤的生长、侵袭和转移。乳腺癌细胞诱导感觉神经元自发钙活性,引发SP的释放。此外,SP升高的患者肿瘤表现出淋巴结转移扩散的增强。SP作用于肿瘤速激肽受体(TACR1),驱动TACR1高含量癌细胞亚群的死亡。
为了系统地分析SP驱动转移的分子基础,作者用DNase、RNase A或热失活处理DRG-CM。用RNase A处理DRG-CM显著削弱了DRG-CM促进球侵袭的能力,而用DNase或热失活处理则没有。这说明ssRNA可以作为DRG-CM对乳腺癌细胞的促侵袭作用的介质。作者还发现,SP可以诱导一部分癌细胞凋亡和随后的ssRNA释放。在TACR1高含量的癌细胞亚群中,神经肽SP导致细胞死亡,导致ssRNAs的释放,从而驱动转移。在小鼠中,ssRNA通过toll样受体7 (TLR7) 来介导RNA感知和先天免疫响应。作者发现,从垂死细胞释放的ssRNA作用于邻近肿瘤TLR7,从而激活转移基因表达程序。这种SP-和ssRNA诱导的Tlr7基因表达特征与乳腺癌生存结果降低有关。TACR1拮抗剂阿瑞吡坦是一类获批的抗恶心药物。最后,作者还确定阿瑞吡坦可以靶向神经肿瘤轴,在多种模型中抑制了乳腺癌的生长和转移。
综上所述,作者发现神经肽SP促进乳腺肿瘤的生长、侵袭和转移。SP作用于TACR1,驱动癌细胞死亡。从垂死细胞释放的ssRNA作用于邻近TLR7,激活转移基因。作者的研究结果表明,神经元可以通过神经肽SP/细胞外ssRNA传感轴,调节乳腺癌转移进展。
模式图(Credit:Nature)
