Cell系列综述:北京协和医学院李宁/王书航总结ADC药物在精准癌症治疗中的挑战与创新解决方案
时间:2025-10-04
Cell系列综述:北京协和医学院李宁/王书航总结ADC药物在精准癌症治疗中的挑战与创新解决方案
来源:生物世界 2025-10-04 14:39
该综述论文探讨了当前精准癌症治疗中,抗体药物偶联物(ADC)面临的挑战与创新解决方案。中国医学科学院北京协和医学院李宁、王书航等人在 Cell 子刊Med上发表了题为:Antibody-drug conjugates: Current challenges and innovative solutions for precision cancer therapy的综述论文。
该综述论文探讨了当前癌症治疗中,抗体药物偶联物(ADC)面临的挑战与创新解决方案。

癌症已成为公共健康的重大负担。理想的癌症疗法应满足两个关键标准:区分和非癌细胞,并有效清除癌细胞。随着时间的推移,癌症治疗策略已显著发展。传统方法如手术、放疗和化疗主要依赖于解剖学和细胞学特征,而和治疗等较新的疗法则利用分子识别和免疫系统调节。靶向特异性是现代癌症治疗的核心,抗体、多肽及其片段提供了精准性,但往往缺乏强大的细胞毒性作用。相反,化疗药物和放射性核素等细胞毒性药物能有效杀死癌细胞,但会引起显著的脱靶毒性。
在 20 世纪初,Paul Ehrlich提出的 魔法子弹 概念,设想了能够选择性靶向病原体结构而对健康细胞无害的疗法。这一理念为抗体药物偶联物(Antibody-drug conjugate,ADC)奠定了基础,ADC 结合了用于肿瘤特异性靶向的单克隆抗体、细胞毒性有效载荷以及用于控制药物释放的连接子。
与单独的抗体相比,ADC 不依赖于抗体依赖的细胞毒作用(ADCC),并且能够靶向对肿瘤生存途径非必需的抗原,从而拓宽了其适用性。同样,ADC 预计会优于传统的细胞毒性药物,因为它们能够将药物效应集中在肿瘤组织内,从而能够使用高活性的细胞毒素。由于其无可比拟的理论优势,ADC 已经引起了极大关注。截至 2024 年,全球已有 15 种 ADC 获得批准上市,其中包括 12 种获得美国 的批准,另有超过 1000 种 ADC 正在研究中:268 种处于临床试验阶段(其中 45 种处于 3 期临床),813 种处于临床前阶段。值得注意的是,曲妥珠单抗德鲁替康(T-DXd,一款靶向 HER2 的 ADC)极大地改变了 HER2 高表达和低表达肿瘤的治疗格局,其应用范围已超出,展现出在泛中的巨大潜力。
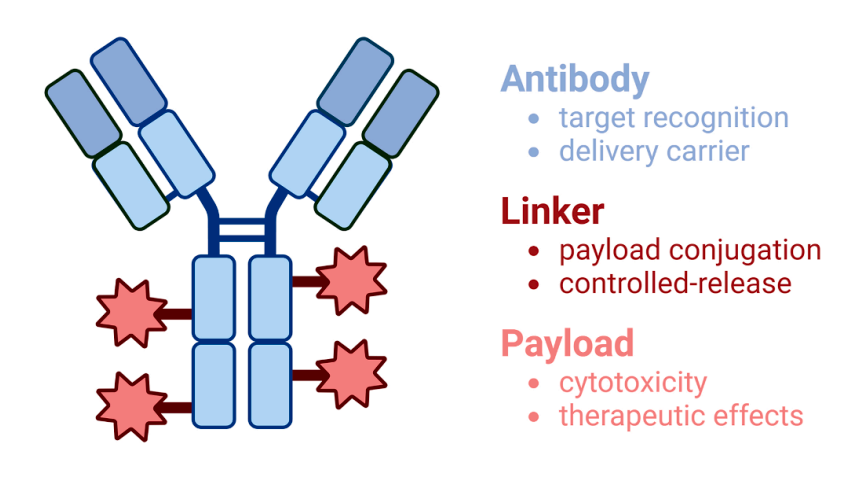
图 1. ADC 的模块化结构:三个模块化组件包括抗体(用于靶点识别和作为药物载体)、连接子(用于有效载荷的偶联以及作为可控释放的媒介)和有效载荷(作为细胞毒性/治疗剂)。这些模块协同作用,实现靶向肿瘤治疗并控制药物释放。
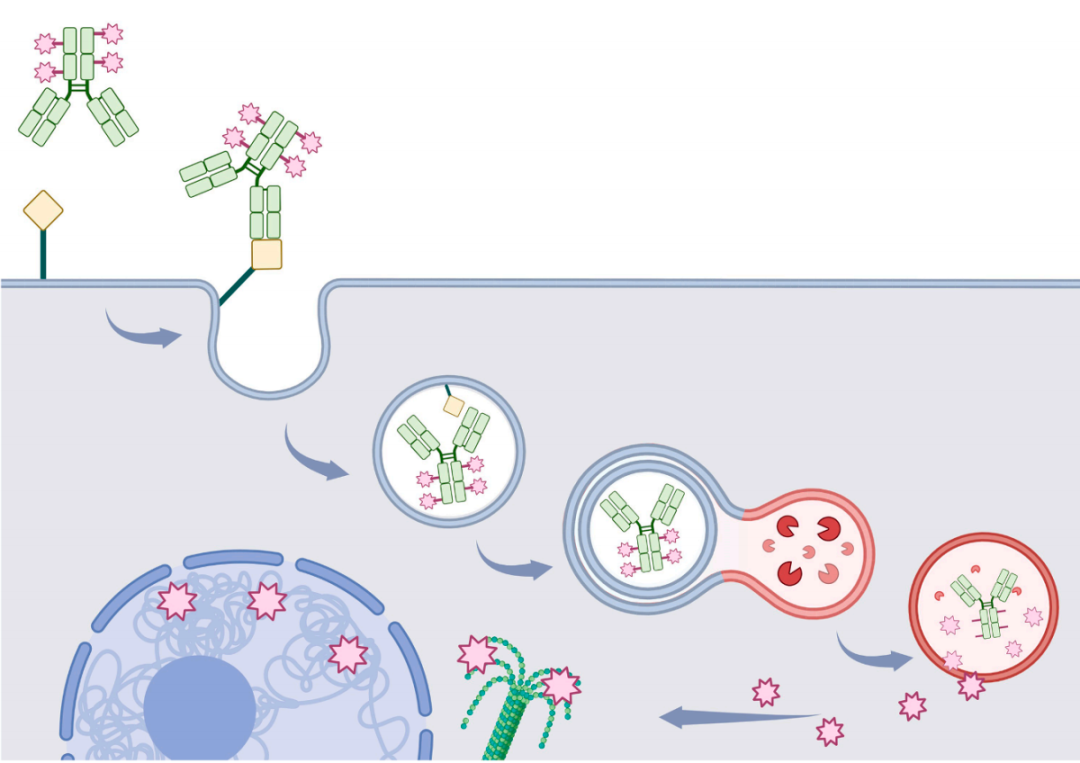
图2. ADC 的基本机制:首先,ADC 特异性地与细胞表面的肿瘤相关抗原结合。随后,通过受体介导的内吞作用,ADC-抗原复合物被内化到内体中,并转运至溶酶体。在溶酶体中,连接子被切割,释放出细胞毒性有效载荷(图示为粉色星形)进入细胞质。释放的药物通过靶向关键的细胞内成分(例如微管或 DNA)诱导细胞死亡。此外,某些有效载荷可能会从靶细胞扩散出来,对邻近细胞产生旁观者杀伤效应。
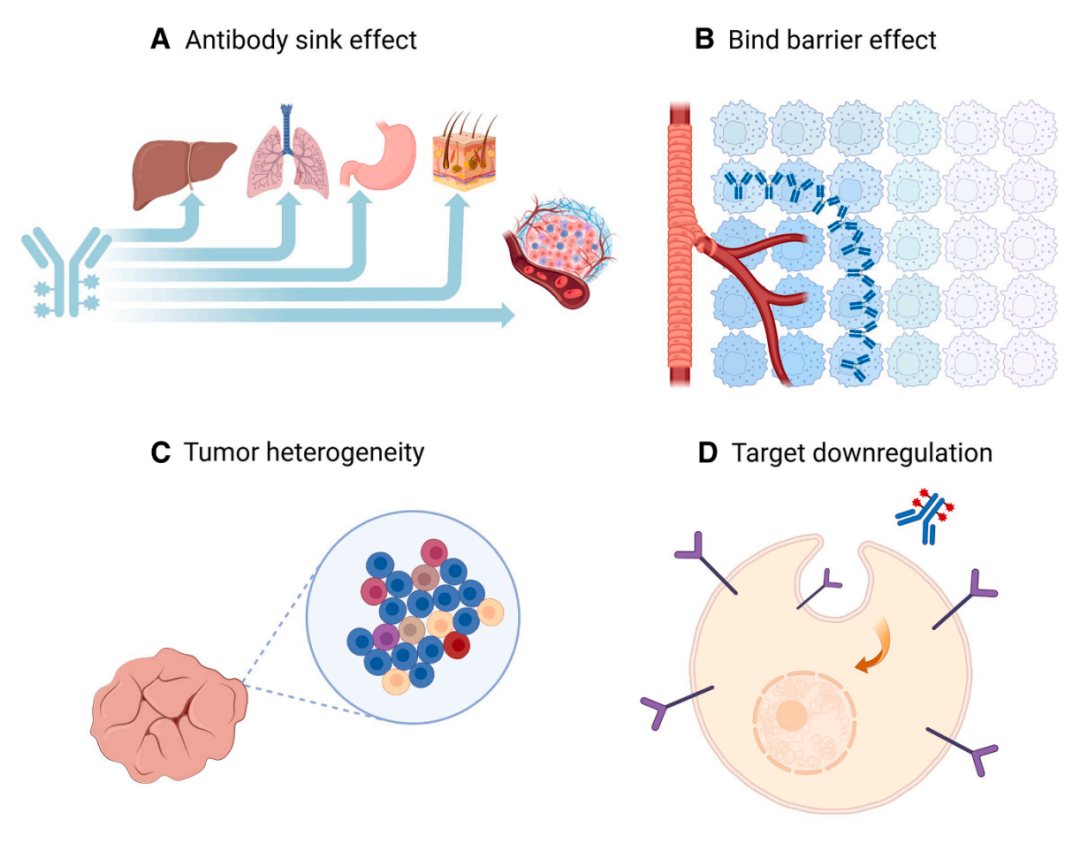
图3. 抗体介导的药物递送系统中限制 ADC 有效性的挑战:A)抗体 汇流 效应:抗体与正常组织(例如肝脏、肺、胃肠道和皮肤)中表达的抗原结合,从而降低药物在肿瘤部位的生物利用度。B)结合位点屏障效应:由于抗体与附近的抗原具有高亲和力结合,限制了药物向肿瘤内部的深入渗透,导致药物在肿瘤内的分布不均。C)肿瘤异质性:间抗原表达不一致,导致 ADC 的摄取量存在差异,治疗效果不均衡。反应。D)肿瘤细胞下调靶点会减少表面抗原的可用性,进一步限制 ADC 的结合和内化,最终影响有效载荷的传递。
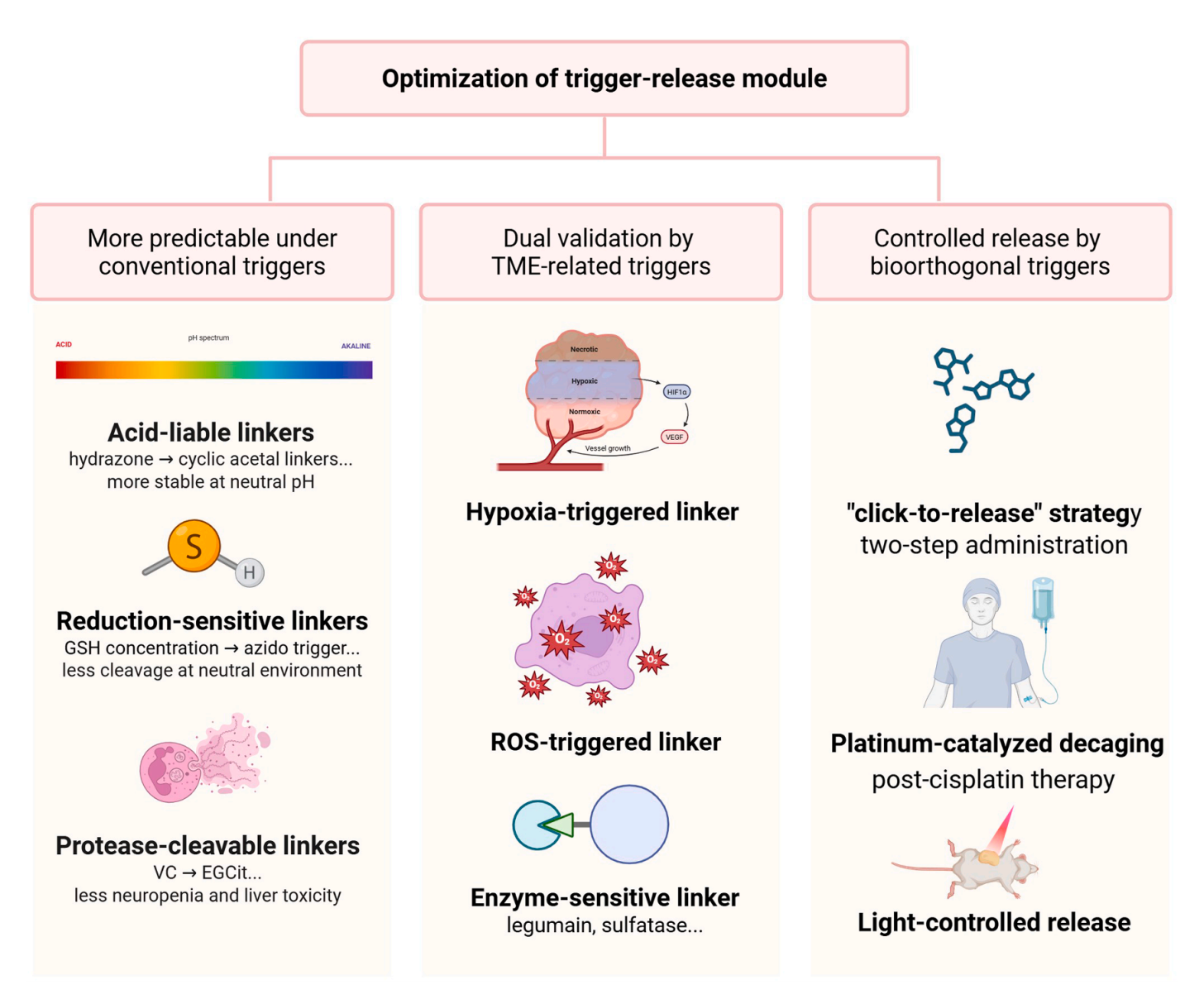
图4. 优化 ADC 触发释放模块以提高特异性和降低脱靶毒性的多种方法:抗体药物偶联物(ADC)连接子的触发释放模块的优化涉及三种方法:对内源性触发器进行改良以提高稳定性和降低毒性,包括在中性 pH 值下稳定的酸敏感连接子、对谷胱甘肽有响应的还原敏感连接子以及可减少全身毒性的蛋白酶可裂解连接子(左);利用肿瘤微环境(TME)相关触发器,借助肿瘤特异性病理线索,如缺氧触发、活性氧(ROS)触发和酶敏感连接子(中);以及通过外源刺激实现可控释放的生物正交触发器,例如点击释放化学、铂催化脱笼和光控释放,确保激活的时空精度(右)。
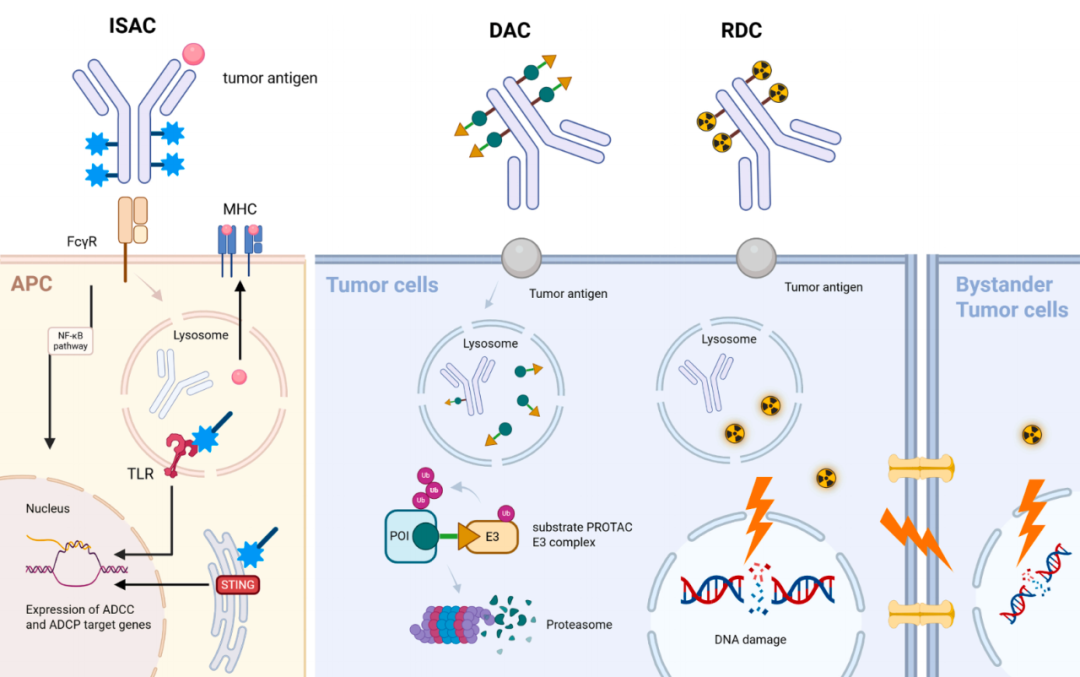
图5. 具有有效载荷多样性的新兴策略(ISAC、DAC 和 RDC)的机制比较:ISAC 通过抗原呈递细胞(APC)中的模式识别受体(PRR)/Toll 样受体(TLR)信号激活先天免疫,从而增强抗癌免疫反应。DAC 利用肿瘤细胞内的 PROTAC 介导的 E3 连接酶募集诱导靶向蛋白降解,从而引发诸如细胞凋亡等抗癌效应。RDC 将放射性毒性有效载荷递送至肿瘤细胞以诱导 DNA 损伤,跨膜辐射还会产生旁观者效应。

图6. 抗原/抗体、连接子和有效载荷的关键问题及解决方案:抗体和靶点方面的问题包括基于免疫组化(IHC)的预测能力弱、肿瘤微环境(TME)分布不佳以及靶点测量有限。解决方案包括改进生物标志物、增强 TME 分布(双特异性抗体药物偶联物)以及动态测量(放射性标记成像)。连接子方面的问题包括稳定性平衡不明确、非肿瘤特异性裂解以及亲水性与旁观者效应之间的权衡。解决方案包括新型触发机制(TME/生物正交)、空间修饰(多臂/仿生)以及药代动力学(PK)优化(药物抗体比/亲水性)。有效载荷方面的问题包括细胞毒性、有限多样性导致的耐药性以及临床前与临床试验之间的转化差距(免疫刺激抗体偶联物)。解决方案包括多样化的有效载荷(DNA 酶/核酶)、组合/序贯策略(人工智能)以及多有效载荷 ADC/耐药性抑制剂。还需要进一步的研究来阐明抗体-连接子-有效载荷之间的相互作用。
该综述探讨了 ADC 开发中的关键问题以及相应的优化策略,讨论了靶抗原表达与临床响应之间的关系以及抗体在靶向之外的作用,总结了通过双特异性靶向和前体抗体掩蔽来增强 ADC 分布的方法;重新评估了连接子设计中的传统假设,例如倾向于最大稳定性,以改善临床结果。连接子化学的创新包括肿瘤微环境响应性释放机制和生物正交反应。新兴的有效载荷策略,例如免疫刺激抗体药物偶联物(ISAC)和降解剂抗体偶联物(DAC),这扩大了治疗可能性,但也带来了新的安全性挑战。最终,仅仅增加 ADC 的结构复杂性是不够的,理解肿瘤递送障碍以及弥合临床前与临床之间的差距对于充分发挥 ADC 在精准肿瘤学中的潜力至关重要。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
