本月话题之「细胞外囊泡」——从科研明星到百亿赛道的崛起与挑战
时间:2025-09-26
来源:100医药网 2025-09-26 09:00
细胞外囊泡领域正处于从基础科学发现向产业化爆发过渡的黄金时期。曾一度被视为细胞 废弃物 的细胞外囊泡(EVs, Extracellular Vesicles),如今已成为生物医学领域最炙手可热的研究明星。这些由细胞主动分泌的纳米级膜性小泡,是细胞间通信的关键信使,承载着蛋白质、核酸、脂质等丰富的生物活性分子,在疾病诊断、药物递送和组织再生等领域展现出前所未有的巨大潜力。
随着基础研究的不断深入和工程化技术的飞速成熟,EVs 产业正挣脱科研探索的襁褓,快步走向波澜壮阔的商业化应用蓝海。本文将全面解析全球 EVs 市场的最新格局、政策监管动向以及令人振奋的前沿研究成果,为您深入剖析这条充满机遇与挑战的高增长赛道。
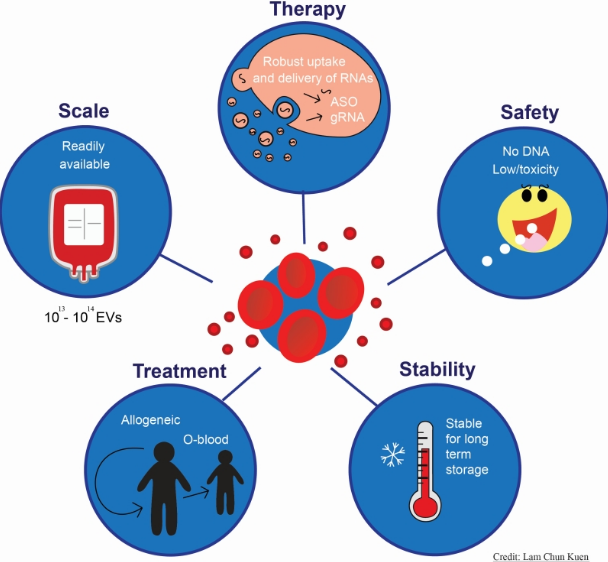
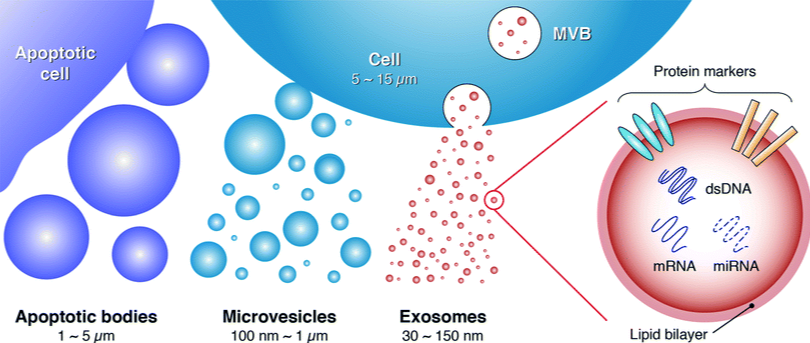
图片来源:cell-stress.com
一、市场篇 群雄逐鹿,百亿赛道初现雏形
全球市场研究机构的数据一致描绘出 EVs 领域高增长的繁荣图景。根据 Grand View Research 的报告,2023 年全球细胞外囊泡市场规模约为 2.81 亿美元;更引人注目的是其未来增速,该机构预测 2024 年至 2030 年,全球 EVs 市场将以 26.2% 的复合年增长率(CAGR)扩张,到 2030 年有望达到 15.6 亿美元。
另一家知名机构 Mordor Intelligence 的预测则更为乐观,其报告显示 2024 年市场规模约为 3.84 亿美元,预计到 2029 年将增长至 11.7 亿美元,期间 CAGR 为 24.88%。尽管具体数字因统计口径略有差异,但两者都明确指向同一结论:EVs 市场正迎来爆发式增长。
这条迅速崛起的赛道背后,是一个日益清晰的产业链:
(一)上游:设备与试剂的核心支撑
上游环节主要由分离提取设备与鉴定仪器供应商主导,为 EVs 研究与生产提供基础工具。核心设备包括:
传统设备:超速离心机(如 Thermo Fisher、Beckman Coulter 产品);
先进分离系统:尺寸排阻色谱(SEC)系统、微流控芯片设备(如默克 Miltenyi Biotec 的 exoEasy 系列);
表征仪器:纳米颗粒跟踪分析仪 NTA(Malvern Panalytical)、可调电阻脉冲传感仪 TRPS(Izon Science);
配套试剂:各类 EVs 提取与检测试剂盒供应商。
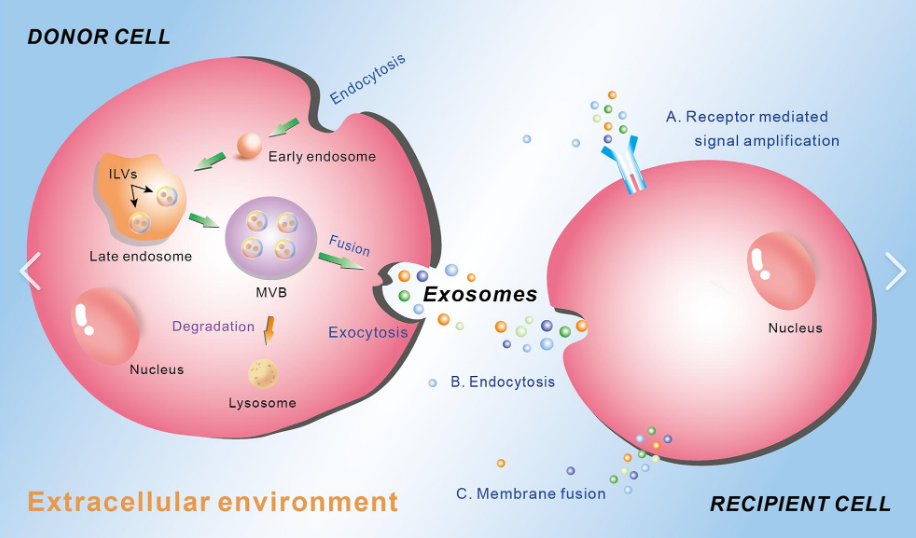
图片来源:Frontiers
(二)中游:创新密集的核心战场
中游是 EVs 产业创新最活跃、资本最密集的核心环节,聚焦于 EVs 衍生治疗药物 / 载体的研发和诊断试剂的开发,全球近 50 家企业在此展开角逐,集中布局肿瘤、脑部疾病等四大领域。
1. 国际代表企业
Evox Therapeutics:这家专注于工程化 EVs 递送疗法的英国公司,2022 年初完成 9600 万美元 C 轮融资,并与武田制药(Takeda)扩大高达 12 亿美元的合作,开发神经系统罕见病 EVs 疗法,彰显了大药厂对该技术平台的认可。
Codiak BioSciences:作为 EVs 领域的上市先驱,曾凭借 engEx 工程化外泌体平台推进多个肿瘤学项目进入临床。但由于领先管线临床数据未达预期及资金链问题,该公司于 2024 年申请破产并出售资产,其历程为行业敲响警钟:技术先进性必须与清晰的临床开发路径、稳健的财务管理相结合。
2. 国内领先企业
中国在 EVs 领域发展势头迅猛,一批创新企业已崭露头角:
恩泽康泰(杭州):国内 EVs 领域头部企业,依托工程化外泌体载药平台与基于组学的诊断平台开发创新产品,2021 年完成近亿元 A 轮融资,2022 年再获数千万元 A + 轮融资,重点布局肿瘤和神经疾病领域。
唯思尔康(苏州):聚焦外泌体创新药物递送平台开发,2021 年完成数千万美元天使轮融资,致力于构建多适应症创新药物研发管线。
宇玫博生物(上海):在工具酶和分子试剂领域积累深厚,其外泌体提取与检测试剂盒占据重要科研市场份额,同时向诊断应用领域拓展。
(三)下游:待激活的应用终端
下游主要包括医院、第三方检验中心(ICL)和科研院所等应用终端。目前 EVs 应用多处于临床研究阶段,但随着产品获批上市,下游市场将被彻底激活。
从应用领域看,药物递送凭借天然优势和巨大治疗潜力占据最大市场份额;其次是癌症诊断与预后监测所属的液体活检领域;再生医学(如干细胞外泌体用于组织修复)作为重要方向,也吸引大量研究与投资。
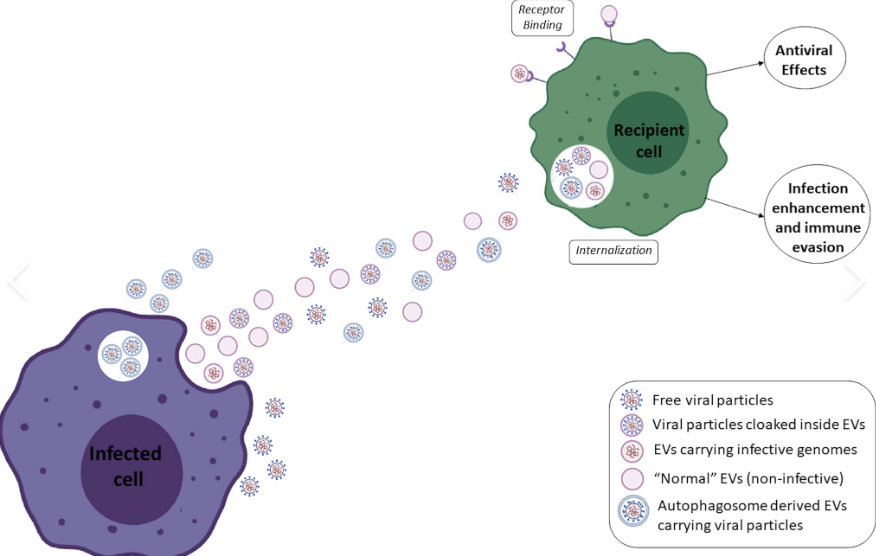
图片来源:Frontiers
二、政策篇 监管框架逐步清晰,助推行业规范发展
EVs产品的监管路径是全球监管机构面临的新课题,清晰的规则是行业健康发展的基石。
(一)国际政策(以/EMA为例):
监管机构根据 EVs 产品预期用途(治疗或诊断)归入不同监管框架:
●治疗性 EVs 产品通常被归类为生物制品(Biologics,美国)或先进疗法医疗产品(ATMPs,欧洲),需通过新药申请(BLA、NDA 或 MAA)途径申报;
●诊断类产品按医疗器械(IVD)管理。
美国 FDA 尚未发布 EVs 专项指南,但通过公开会议明确审评考量,强调 EVs 产品开发必须解决关键质量属性(CQAs),包括身份识别、纯度、效价、杂质控制(如宿主细胞蛋白、DNA)及安全性(无菌、内毒素)。对于工程化 EVs,修饰成分及潜在免疫原性风险需重点评估。FDA 鼓励开发者早期与生物制品审评与研究中心(CBER)沟通,明确开发路径。
(二)国内政策(以NMPA为例):
目前我国国家药品监督管理局(NMPA)及药品审评中心(CDE)正积极构建 EVs 监管科学体系,2025 年 6 月 CDE 发布的《先进治疗药品的范围、归类和释义(征求意见稿)》,首次在国家层面将细胞外囊泡(EVs)正式纳入 先进治疗药品 (ATMP)的监管范畴,将其归类为 细胞衍生物药品 和 新型递送系统 。
此前,2021 年 CDE 发布的《基于人源干细胞衍生产品药学研究与评价技术指导原则(试行)》,虽主要针对干细胞衍生产品,但对外泌体等活性物质的生产用细胞、工艺、质量控制、稳定性等提出的要求,为干细胞来源 EVs 治疗产品申报提供了重要参考。
对于创新产品,NMPA 设立 创新型医疗器械特别审查程序 (绿色通道)和 突破性治疗药物程序 。尽管目前尚无 EVs 产品通过这些程序的公开案例,但随着技术成熟和数据积累,具备显著临床优势的 EVs 产品极有可能入选以加速审评。此外, 十四五 规划将生物经济列为战略性新兴产业,支持基因治疗、细胞治疗等前沿技术,为 EVs 产业提供了有利宏观环境。
需特别注意的是,我国《化妆品安全技术规范》(2015 年版)明确禁止 人的细胞、组织或人源产品 用于化妆品,因此人源外泌体在化妆品领域处于禁用状态。
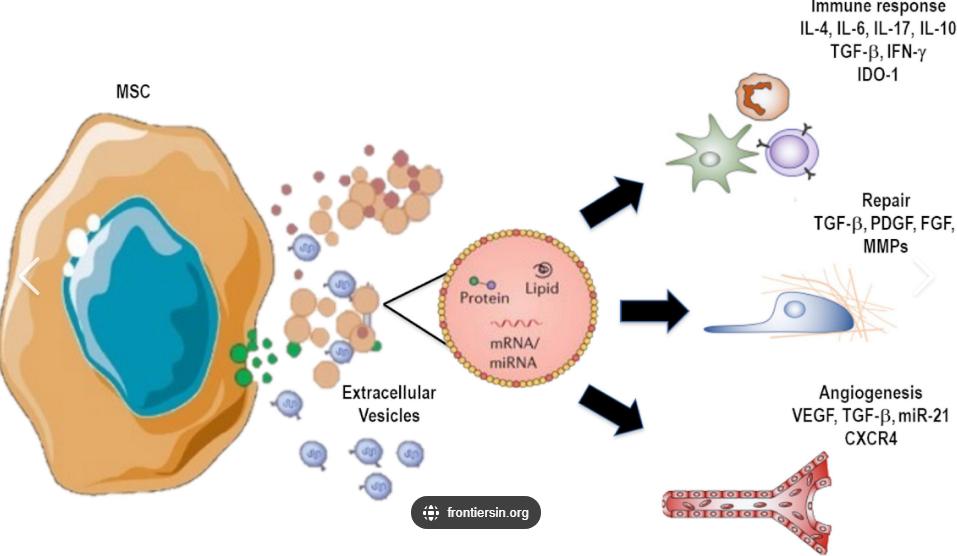
图片来源:frontiersin.org
三、研究篇 基础临床双突破,技术革新驱动产业升级
过去一两年间,EVs领域的基础与临床研究取得了令人瞩目的进展。
(一)疾病诊断:液体活检的 新利器
EVs存在于各种体液中,其携带的核酸和蛋白信息提供了疾病的实时 快照 ,是液体活检的理想来源。
1、癌症早期:2023年,一项发表于Journal of Extracellular Vesicles上的研究开发了一种基于EVs表面特定蛋白组合的血液检测方法,在区分早期患者和健康志愿者方面表现出极高的灵敏度和特异性,为这种 癌王 的早期发现带来了新希望。
2、神经退行性疾病:(AD)的诊断长期以来缺乏可靠的血液标志物。2024 年 11 月发表于《Nature Neuroscience》的研究进一步揭示,tau 蛋白纤维可被选择性包装并锚定在 EV 膜上,为通过 EV 检测实现 AD 早期诊断提供了新机制依据。此前 2022 年的相关研究也显示,检测神经元来源 EV 中的磷酸化 Tau(p-tau)和 A 42 蛋白,可在症状出现前识别 AD 高风险个体,展现出 EVs 在神经疾病超早期诊断中的潜力。
(二)药物递送:天然高效的 纳米快递
利用工程化技术改造EVs,将其打造为靶向递送药物的 特洛伊木马 ,是当前研究的热点。
1、递送核酸药物:Evox Therapeutics等公司的核心技术正是对EVs进行工程化修饰,在其表面表达靶向肽,并内部装载siRNA或mRNA。2023年的临床前研究显示,其设计的EVs能高效穿过血脑屏障,将治疗性RNA递送至大脑深处,显著改善了罕见脑病模型小鼠的生存期。
2、递送基因编辑工具:将强大的CRISPR-Cas9基因编辑系统安全、高效地递送到特定细胞是领域的难点。2024年初,哈佛大学医学院的研究团队在Science Advances杂志上发表成果,他们开发了一种新型EVs包裹的CRISPR-Cas9系统,成功在体内实现了高效的基因编辑,且免疫原性远低于传统的病毒载体,为基因治疗开辟了新途径。
(三)再生修复:组织再生的 通信兵
间充质干细胞(MSC)的大部分修复功能被认为是通过其分泌的EVs(MSC-EVs)介导的。MSC-EVs通过传递活性物质调控免疫、促进生成和抑制纤维化。
1、:多项进入I期或II期临床试验的研究正在评估MSC-EVs治疗心肌梗死后的安全性和有效性。初步结果显示,通过心包灌注或EVs能够改善心脏功能,减少瘢痕组织。
2、皮肤愈合:国内多家机构研究表明,MSC-EVs 能显著促进糖尿病足等难愈性创面愈合,机制与调节炎症微环境、促进成纤维细胞增殖及胶原沉积相关。目前国内已建成首个符合 GMP 标准的外泌体生产基地,单批次产能达 500 升,年产量超 100 万支冻干制剂。
(四)技术革新 分离鉴定的 新武器
为解决 EVs 异质性和标准化难题,新技术不断涌现:
分离技术:非对称流场流分离(AF4)作为高分辨率技术,可按尺寸更好地分离 EVs 亚群;
检测技术:数字 PCR(dPCR)和第二代测序(NGS)的应用,实现了 EVs 内痕量核酸分子的精准绝对定量与发现。
这些技术进步为 EVs 质量控制和生物学功能研究提供了强大工具。
图片来源:Royal Society of Chemistry
四、挑战与展望
尽管前景光明,但EVs从实验室走向广泛临床应用的道路仍面临几大核心挑战:
(1)标准化问题:目前尚无全球统一的EVs分离、纯化、表征和功能分析的金标准,不同实验室、公司采用的方法各异,导致研究数据难以比较和重复,这是转化的首要障碍。
(2)规模化生产:如何从实验室级的毫升制备放大到满足临床需求的百升级别的GMP(良好生产规范)生产,同时保证EVs的产量、纯度和功能活性,是产业化必须逾越的鸿沟。
(3)载药效率与靶向性:虽然工程化技术日益成熟,但如何实现药物的高效装载,并确保工程化EVs在体内的靶向精确性和可控性,仍需进一步优化。
(4)监管与审批路径:监管框架仍在不断完善中,开发者与监管机构需要持续沟通,共同探索和确立适用于EVs这类创新产品的审评标准。
面对挑战,EVs 领域的发展展望清晰可见:
●产品上市突破:未来 3-5 年,有望出现首个获批上市的 EVs 伴随诊断试剂或基于 MSC-EVs 的再生疗法。
●技术深度融合:人工智能(AI)将深度参与 EVs 研究,用于挖掘疾病特异性标志物、预测最佳药物装载方案、设计高亲和力靶向配体。
●个性化治疗落地:利用患者自身细胞产生 EVs,经工程化改造后用于个体化治疗,可最大程度降低免疫排斥风险。
小结
细胞外囊泡领域正处于从基础科学发现向产业化爆发过渡的黄金时期。尽管在标准化、规模化生产和监管方面仍面临严峻挑战,但不断扩张的市场规模、日益清晰的政策指引及日新月异的技术突破,正为 EVs 成为革命性疾病诊疗工具铺平道路。
Codiak 的案例提醒我们产业化道路并非一帆风顺,而 Evox 的成功融资与合作、国内 GMP 生产基地的建成则证明了行业的巨大长期价值。这条汇聚生命科学前沿智慧、资本力量和政策支持的高增长赛道,无疑值得科学家、产业界和投资者给予最大关注与最理性投入。(100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
