Theranostics:肿瘤细胞借胞外囊泡传递Twist1至大脑,诱导神经元异常与癌症相关性抑郁
时间:2025-09-22
来源:100医药网 2025-09-22 14:32
研究发现肿瘤来源的胞外囊泡携带Twist1,经血液到达小鼠内侧前额叶皮层,抑制PPAR-δ致神经元树突萎缩,引发抑郁样行为,揭示癌症相关性抑郁新机制并提供潜在治疗靶点。
对癌症患者而言,除了肿瘤本身的治疗压力,抑郁往往是另一重 隐形负担 临床数据显示,癌症患者抑郁发生率是普通人群的3-5倍,不仅降低,还会加剧治疗负担、升高死亡风险,而常规药对这类抑郁的疗效有限。长期以来,癌症与抑郁之间的具体分子关联始终未被明确,这也成为临床治疗的关键瓶颈。
近日,发表在Theranostics一项研究Extracellular vehicles-mediated Twsit1 transferred from tumor cells to brain induces depressive-like behaviors via neuronal morphogenesis,从 跨器官通讯 视角破解了这一难题,为癌症相关性抑郁的治疗提供了全新方向。

研究团队首先构建了三种荷瘤小鼠模型(分别接种4T1细胞、Lewis细胞、MC38细胞),21天后观察到所有荷瘤小鼠均出现典型抑郁样行为:蔗糖偏好测试中偏好度显著降低(提示快感缺乏),尾悬挂试验和强迫游泳试验中不动时间延长(提示行为绝望),且4T1荷瘤小鼠的抑郁表型最为突出,因此后续以4T1模型为核心展开机制探索。考虑到分泌的胞外囊泡(EVs)可通过循环系统介导远距器官间的信息传递,研究人员通过超速离心分离4T1细胞来源的EVs,证实其具有典型杯状形态,且表达TSG101、CD9等EVs特异性标志物;进一步用EVs分泌抑制剂GW4869处理4T1荷瘤小鼠,发现小鼠循环EVs水平降低的同时,抑郁样行为也明显缓解,直接证实EVs是癌症相关性抑郁的关键介导因子。更重要的是,向正常小鼠静脉或鼻内注射4T1细胞来源的EVs,均能诱导其出现抑郁样行为,且不影响自主活动能力,说明肿瘤来源EVs可独立引发抑郁表型。
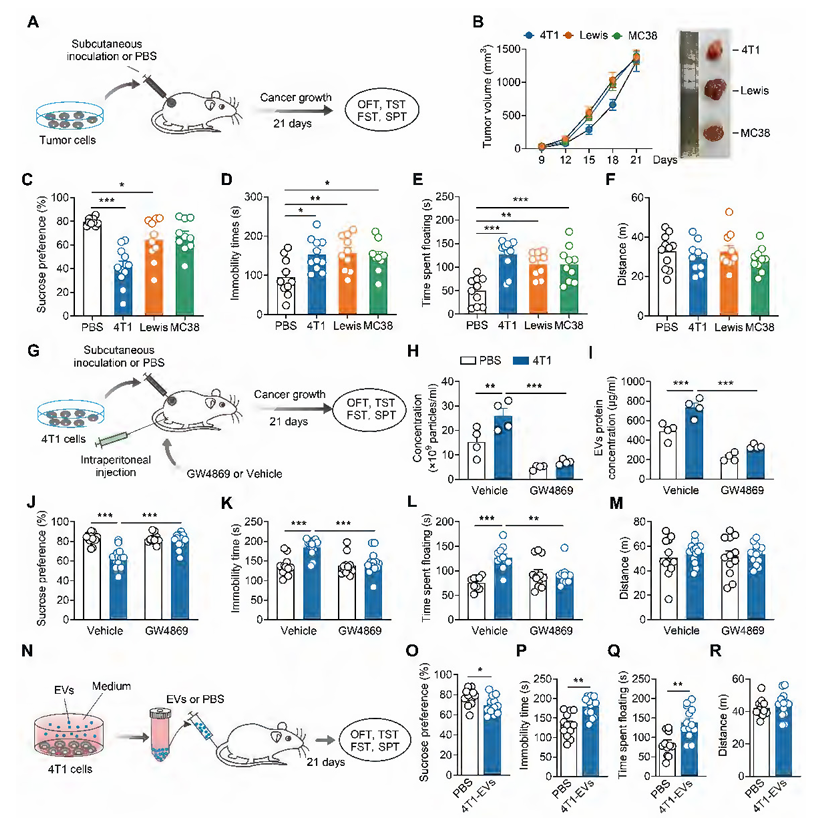
图1. 肿瘤来源的胞外囊泡促进抑郁样行为
为明确EVs中的核心致病成分,研究团队聚焦于原癌基因Twist1 该基因不仅驱动肿瘤进展与转移,此前研究还发现慢性应激可诱导其在大脑内侧前额叶皮层(mPFC)表达升高并引发抑郁。检测显示,荷瘤小鼠血清来源EVs(SDEVs)中Twist1 mRNA水平显著升高,且这些Twist1 mRNA被EVs包裹保护,仅在破坏EVs膜结构(加入Triton X-100)后才会被RNase A降解;同时,荷瘤小鼠mPFC中Twist1 mRNA和蛋白水平均升高,其下游靶标PPAR- (过氧化物酶体增殖物激活受体 )蛋白水平则降低。通过立体定位注射慢病毒敲低mPFC中的Twist1,荷瘤小鼠的PPAR- 表达恢复,抑郁样行为也完全消失,证实Twist1/PPAR- 信号通路是调控癌症相关性抑郁的核心机制。
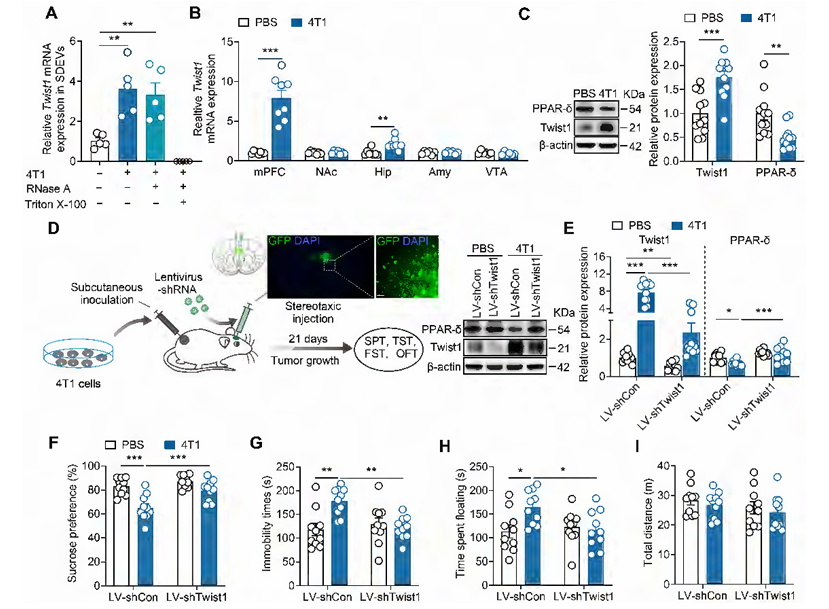
图2. 抑制Twist1/PPAR- 信号通路可改善荷瘤小鼠的抑郁样行为
为进一步验证肿瘤细胞来源Twist1的必要性,研究团队构建了稳定敲低Twist1的4T1细胞系,发现其分泌的EVs中Twist1 mRNA水平显著降低。将这些细胞接种给小鼠后,不仅肿瘤生长受到抑制,小鼠也未出现抑郁样行为,且mPFC中Twist1水平降低、PPAR- 水平升高,这一结果直接证明:肿瘤细胞通过EVs传递Twist1,是引发下游抑郁反应的关键环节。
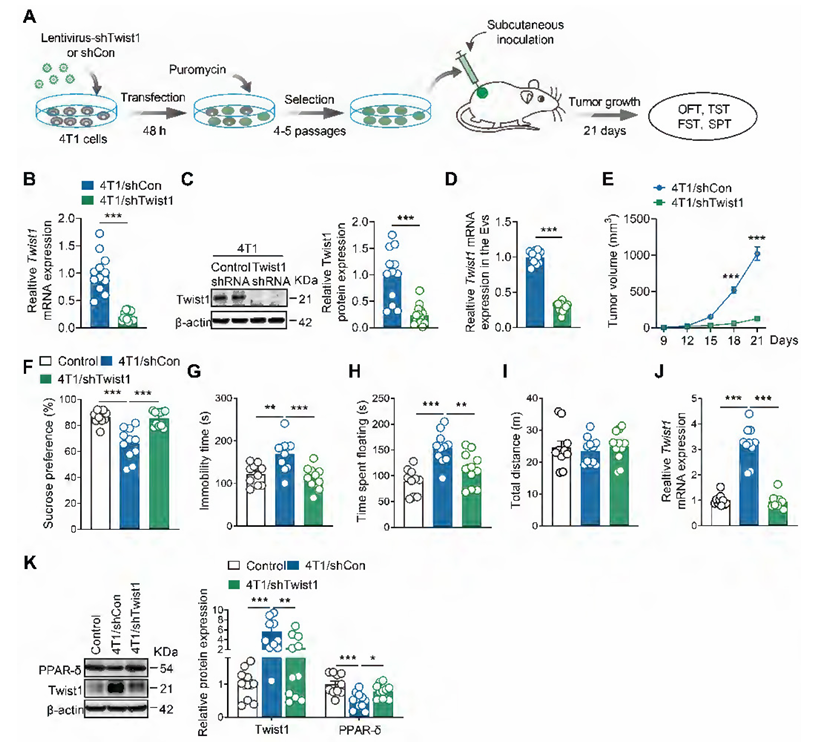
图3. 敲低肿瘤细胞中的Twist1可阻止荷瘤小鼠出现抑郁样行为
研究团队还通过血清来源EVs(SDEVs)的转移实验进一步验证:将4T1荷瘤小鼠的SDEVs给正常小鼠,可诱导后者出现抑郁样行为且mPFC中Twist1表达升高;而注射敲低Twist1的4T1荷瘤小鼠SDEVs,则无此效果;鼻内注射SDEVs也得到了一致结果,说明血液中的肿瘤来源EVs可通过不同途径到达大脑,传递Twist1并诱发抑郁。
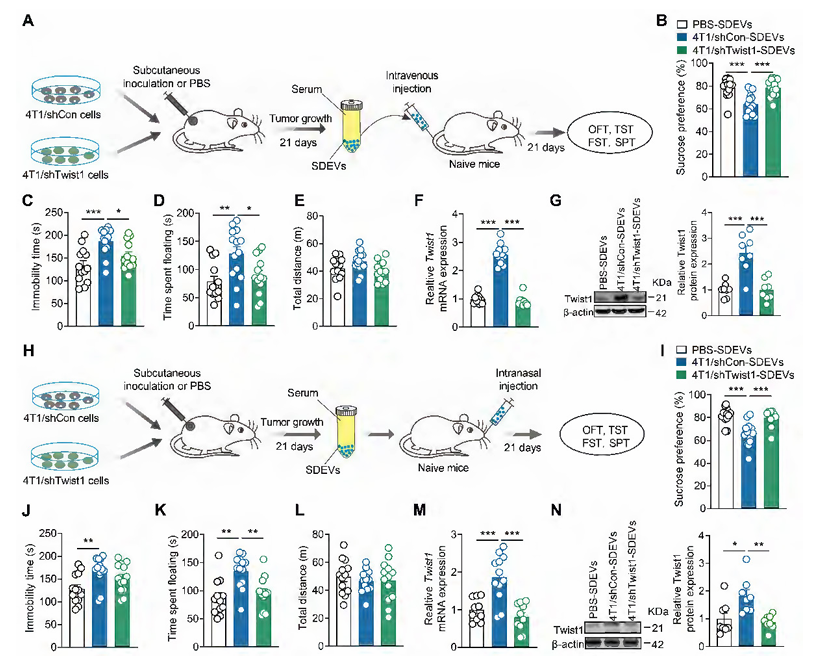
图4. 注射荷瘤小鼠血清来源的胞外囊泡可诱导正常小鼠出现抑郁样行为
从细胞形态机制看,研究发现肿瘤来源EVs携带的Twist1会直接破坏神经元结构:静脉注射荷瘤小鼠SDEVs的正常小鼠,其mPFC II/III层锥体细胞的树突复杂度、分支数量和总长度均显著降低;体外实验也显示,4T1细胞来源EVs可诱导原代皮质神经元出现树突萎缩,而敲低Twist1后,EVs对神经元形态的破坏作用完全消失,表明Twist1通过抑制神经元树突发生,最终引发抑郁样行为。
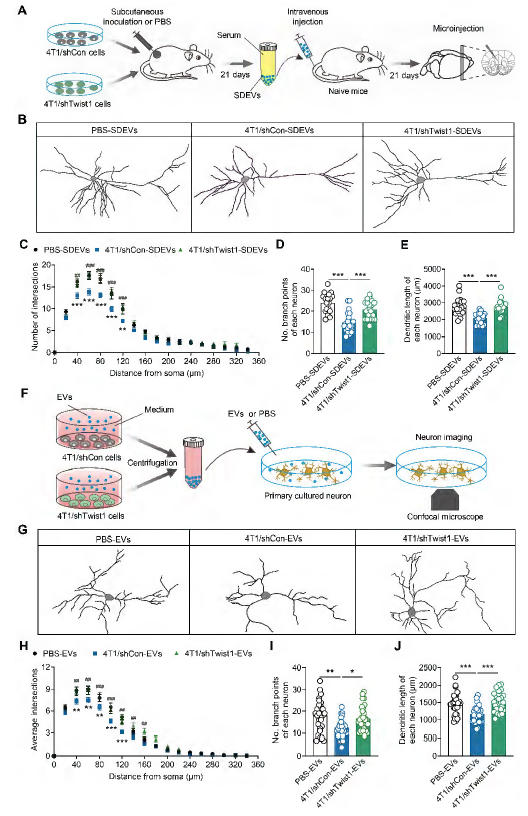
图5. 肿瘤来源的胞外囊泡所携带的Twist1导致神经元树突发生异常
这项研究首次完整揭示了癌症相关性抑郁的 跨器官调控通路 肿瘤细胞分泌的EVs携带Twist1进入循环,到达大脑mPFC后,通过抑制PPAR- 破坏神经元树突形态,最终引发抑郁样行为。这一发现不仅填补了癌症与抑郁分子关联的研究空白,更为临床治疗提供了明确靶点:无论是抑制肿瘤来源EVs的分泌,还是靶向Twist1/PPAR- 信号通路,都有望成为改善癌症患者状的特异性策略,为同时应对癌症本身与 隐形抑郁负担 提供了新的科学依据,也为后续开发针对性治疗方案奠定了基础。(100yiyao.com)
参考文献:
Zou RS, He JG, Zhao Y, et al. Extracellular vehicles-mediated Twsit1 transferred from tumor cells to brain induces depressive-like behaviors via neuronal morphogenesis.Theranostics. 2025;15(17):8985-9000. Published 2025 Aug 16. doi:10.7150/thno.112238
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
