Cell子刊:华人学者开发新型纳米药物,穿越血脑屏障,治疗阿尔茨海默病
时间:2025-08-11
来源:生物世界 2025-08-11 10:57
该研究开发了一种脑靶向的二氧化铈纳米颗粒(T-CeNP),其由粒径极小的多功能酶 CeNP 和靶向晚期糖基化终产物(RAGE)的多肽组成。数十年来,(AD)的研究一直围绕着两个潜在的关键神经病理学特征展开 大脑中 -淀粉样蛋白(A )以斑块形式积聚以及由 tau 蛋白诱导的神经原纤维缠结形成。然而,近期针对 A 和 tau 蛋白以延缓阿尔茨海默病进展的临床研究中所取得的有限成效,这对传统观念提出了挑战,表明仅存在 A 积累或 tau 蛋白病理可能不足以导致痴呆。
正在进行的研究表明,异常蛋白质沉积和折叠被视为阿尔茨海默病(AD)的病理特征,而非其发病机制,但同时也充分考虑了它们对阿尔茨海默病的进展的有害和加重作用。与此同时,还有研究揭示,主要由小胶质细胞引发的慢性神经炎症,是阿尔茨海默病进展的另一个关键因素。
尽管学术界和工业界为研发阿尔茨海默病(AD)疗法投入了大量精力,但目前仍缺乏能够治愈或阻止其发展的有效方法。越来越多的证据表明,功能失调的小胶质细胞在阿尔茨海默病(AD)的发病和进展中发挥着关键作用,它们会促进有害蛋白质沉积物的异常积累,并引发强烈的神经炎症。
2025 年 8 月 6 日,南卡罗来纳大学徐培盛团队在 Cell 子刊Cell Biomaterials上发表了题为:Ceria nanocluster-based therapy for Alzheimer s disease through the modulation of activated microglia and attenuation of amyloid- deposition的研究论文。
该研究开发了一种脑靶向的二氧化铈纳米颗粒(T-CeNP),其由粒径极小的多功能酶CeNP 和靶向晚期糖基化终产物(RAGE)的多肽组成,这两个关键成分既独立作用,又协同作用,能够有效穿透血脑屏障(BBB),快速持续地缓解神经炎症,减轻 -淀粉样蛋白(A )沉积,并调节活化的小胶质细胞,从而缓解或阻止阿尔茨海默病的进展。

在这项最新研究中,研究团队开发了一种脑靶向的二氧化铈纳米颗粒(T-CeNP),通过模拟超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的双重抗氧化活性,从而提出了一种针对阿尔茨海默病(AD)的创新治疗策略。该纳米颗粒通过修饰靶向晚期糖基化终末产物受体(RAGE)的多肽实现三重功能协同:
1、穿越血脑屏障:RAGE 靶向配体有效介导 T-CeNP 穿越血脑屏障,突破传统纳米药物治疗的递送瓶颈;
2、 靶向调控病理进程:T-CeNP 不仅抑制 -淀粉样蛋白(A )纤维化形成,还通过激活小胶质细胞,增强其对 A 的吞噬清除能力;
3、多通路协同作用:在 AD 小鼠模型中,T-CeNP 成功实现活性氧(ROS)清除、抑制小胶质细胞过度活化、阻断 A 病理性聚集,并促进其代谢清除,从而显著延缓阿尔茨海默病的进展。
该研究的亮点:
RAGE 靶向多肽对于血脑屏障的穿透以及 T-CeNP 的功能至关重要; T-CeNP 在 A 的命运和小胶质细胞的活化方面具有多种功能; T-CeNP 调控大脑微环境并减缓阿尔茨海默病的进展。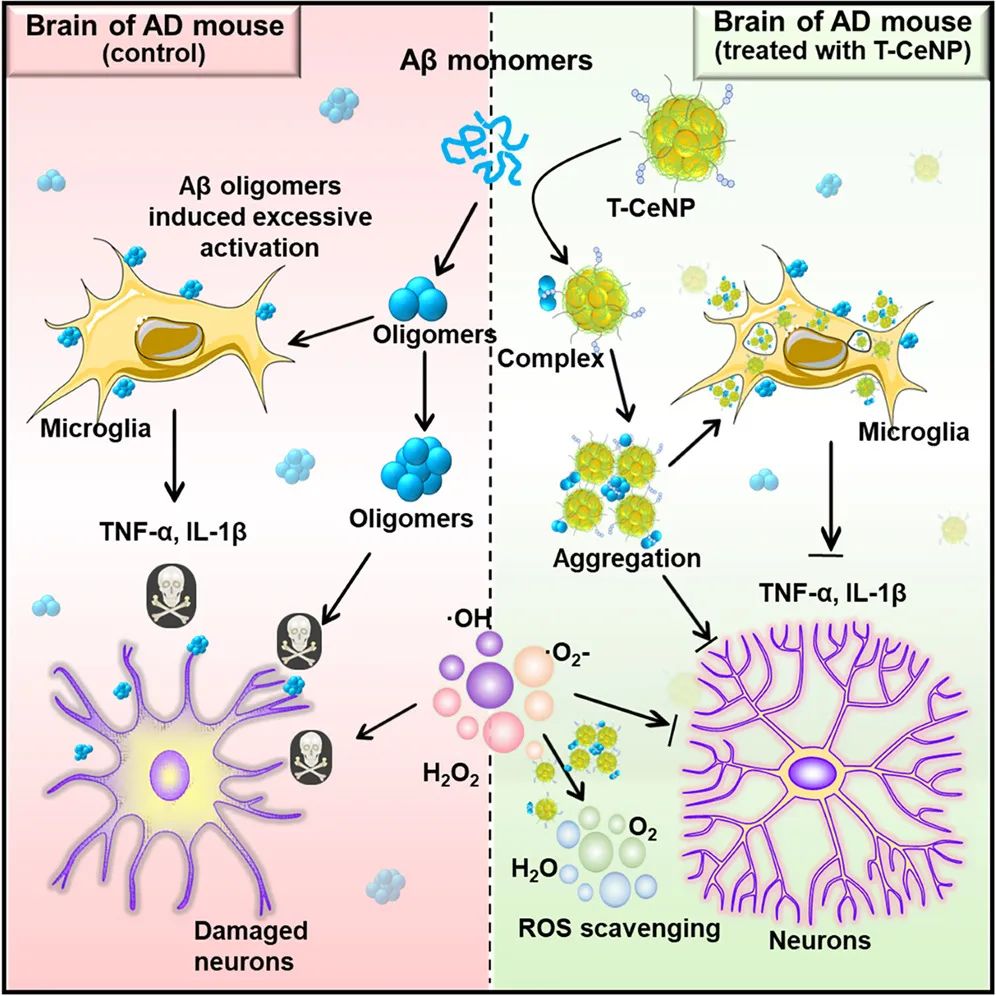 总的来说,该研究开发的 T-CeNP 通过调节神经炎症微环境和淀粉样蛋白代谢的双重通路,有效阻断了阿尔茨海默病病理级联反应,该研究为开发基于纳米酶的神经退行性疾病多靶点治疗提供了新的设计范式。
总的来说,该研究开发的 T-CeNP 通过调节神经炎症微环境和淀粉样蛋白代谢的双重通路,有效阻断了阿尔茨海默病病理级联反应,该研究为开发基于纳米酶的神经退行性疾病多靶点治疗提供了新的设计范式。

