向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫
时间:2025-07-31
向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫
来源:梅斯学术 2025-07-31 10:00
这项受壁虎启发的SDPs药物递送平台,堪称一次将“自然智慧”与“工程创新”完美融合的案例。在癌症治疗这条不断求索的道路上,如何精准、高效地将药物送达病灶,一直是科研人员攻克的重点难题。尤其在膀胱癌治疗领域,传统治疗方式存在药物保留时间短、副作用大等瓶颈,令患者身心俱疲。但最近,一项刊登在Advanced Materials上的研究为这个难题带来了令人振奋的转机:美国科罗拉多大学博尔德分校与安舒茨医学中心的研究团队,巧妙借鉴壁虎脚的黏附机制,开发出一种新型 软树枝状颗粒 (Soft Dendritic Particles, SDPs)药物递送平台,有望彻底刷新膀胱癌的治疗方式。

DOI:10.1002/adma.202505231
从壁虎脚掌获得灵感:
解决药物 留不住 的老难题
膀胱癌作为全球高发癌症之一,其治疗离不开膀胱内给药的局部灌注手段。然而,由于膀胱的排空特性,传统药物往往在体内 停不住脚 ,治疗效果大打折扣,同时可能引发不必要的系统性副作用。因此,研究者迫切需要找到一种能 牢牢抓住 膀胱内壁、延长药物释放时间的新方式。
这时,大自然中的 攀爬高手 壁虎为科学家们提供了灵感。壁虎脚掌下密密麻麻的微纳米结构,能让它在光滑玻璃或墙壁上 自由行走 ,靠的正是纳米尺度的范德华力。这种非化学的、物理黏附机制被研究团队 搬运 进了他们的新药物递送平台 SDPs。该颗粒由生物可降解材料PLGA(聚乳酸-羟基乙酸共聚物)制成,并在表面包裹一层壳聚糖,既提升了黏附性,又确保了生物相容性和可降解性。
在这项研究中,研究团队采用了一种名为 流体流动模板法 的工艺来制备SDPs。他们将PLGA溶液注入剪切力作用下的抗溶剂介质中,使其沉淀形成表面覆盖纳米纤维冠的软颗粒。这些纳米纤维结构正是模拟了壁虎脚掌的微观构造,能通过范德华力牢牢吸附在各种表面上,包括癌细胞的细胞膜,从而为药物在体内的 驻留作战 提供了强有力的物理基础。
为了进一步增强颗粒与生物组织之间的亲和力,研究者还在SDPs的表面涂覆了一层壳聚糖。这是一种来源于甲壳类动物的天然阳离子多糖,具有良好的生物相容性和可降解性,是当前药物递送系统中广泛应用的功能化材料。壳聚糖的加入不仅增强了SDPs对膀胱上皮的黏附能力,也为后续的药物释放过程提供了更可控的环境。

壳聚糖包覆的PLGA软树枝状颗粒(SDPs)的制备过程以及它们在癌症治疗中的应用
在对SDPs进行结构表征的过程中,研究团队发现,通过调节制备过程中流体的雷诺数(Reynolds number),可以精准控制颗粒的最终形态。随着雷诺数的升高,颗粒外观从球形逐渐演变为纤维状,最终呈现出类似 树枝 的复杂分支结构。实验结果表明,当雷诺数达到约100000时,所得SDPs的纳米分支最为丰富,比表面积大幅增加,从而显著提升了颗粒与细胞、组织之间的接触面积和黏附强度。
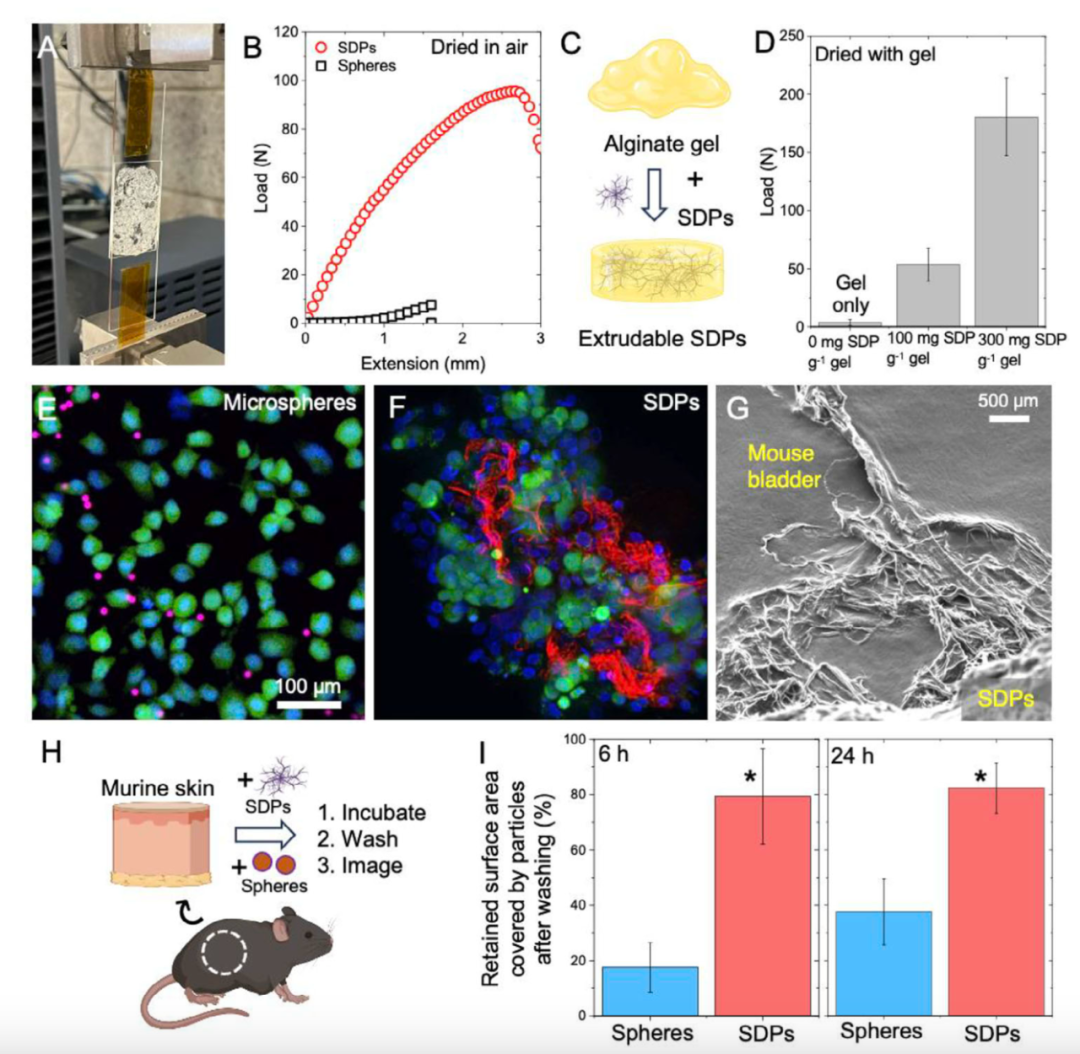
SDPs与细胞和软组织的粘附性能,以及它们在体内的分布和保留情况
在药物负载实验中,团队选用了三种在临床膀胱癌治疗中常见的化疗药物:吉西他滨(gemcitabine)、多西他赛(docetaxel)和甲氨蝶呤(methotrexate)。这些药物的分子特性差异较大,溶解性也各不相同。研究人员通过调整溶剂比例与包载方法,成功将它们分别加载进SDPs之中。为了进一步验证药物释放性能,他们采用紫外-可见光谱法(UV vis spectroscopy)对SDPs中的药物释放动力学进行了动态监测,确保在实际治疗环境中实现缓慢、稳定、可控的药物释放效果。
在体外与体内,
SDPs都表现出不俗实力
实验结果表明,SDPs在体外对小鼠和人类癌细胞的黏附能力可持续数天,显著优于传统药物递送系统。在药物释放方面,SDPs能够有效包载并释放上述三种化疗药物,且释放速率与药物的分子量和溶解性密切相关。例如,甲氨蝶呤(一种水不溶性药物)的释放速率最快,而多西他赛(分子量较大)的释放速率最慢。这种差异表明,SDPs的药物释放机制主要依赖于药物分子从PLGA基质中的扩散,而非聚合物的降解。
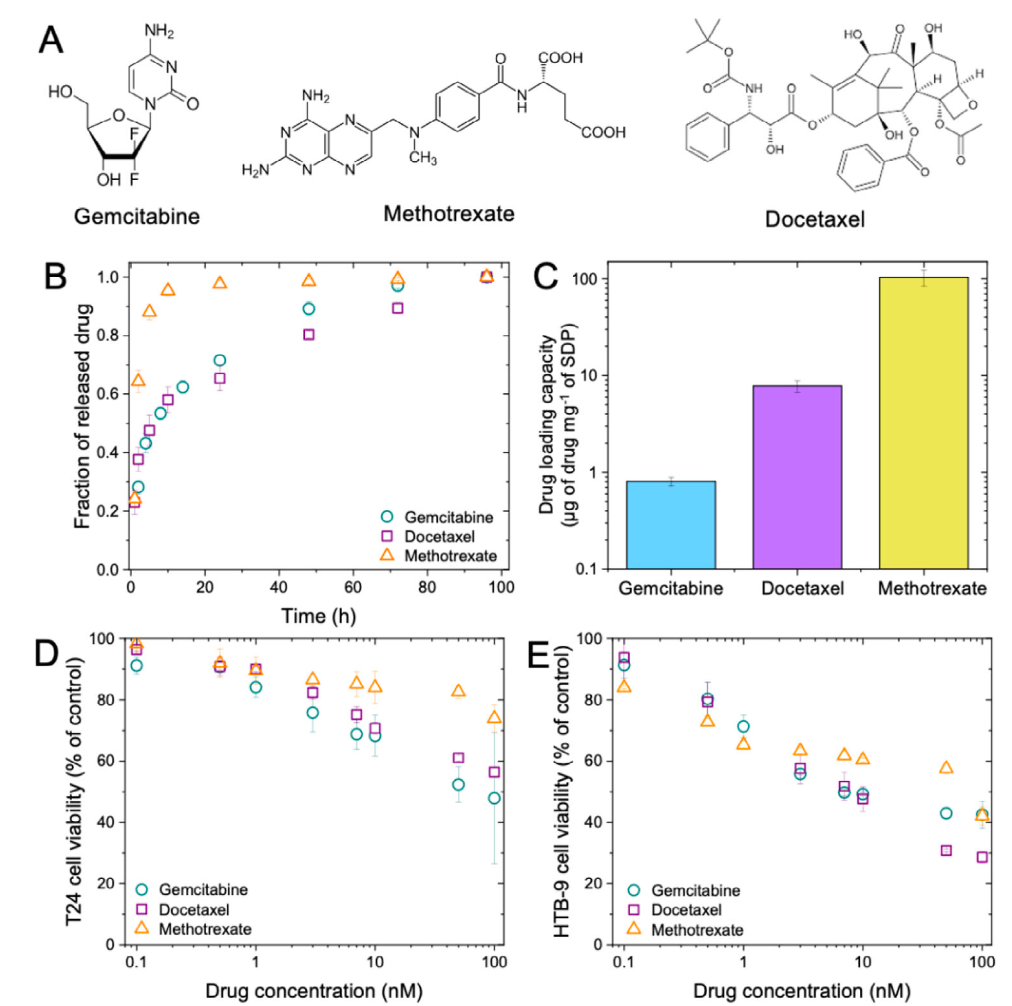
三种化疗药物在SDPs中的包封、释放动力学以及对人类癌细胞活力的影响
在细胞实验中,SDPs对T24和HTB-9两种人类膀胱癌细胞系的毒性表现出明显的剂量依赖性。随着SDPs浓度的增加,细胞存活率显著下降,这表明SDPs能够有效地将化疗药物递送到癌细胞中,并发挥杀伤作用。
更进一步地,研究者们在小鼠膀胱癌模型中进一步测试了SDPs的实际疗效。他们将负载吉西他滨的SDPs(GEM-SDPs)直接灌注进小鼠膀胱中。治疗结果显示,GEM-SDPs不仅抑制了肿瘤生长,还显著增加了肿瘤部位的CD45+免疫细胞浸润,暗示这种递送平台可能还具备调动机体免疫系统、增强抗癌反应的潜力。
与此同时,安全性评估结果也令人安心。尽管部分小鼠在治疗过程中出现ALT略升高和血小板计数下降,但整体未观察到严重的系统性毒性反应,显示SDPs在保证疗效的同时,具备良好的生物安全性。
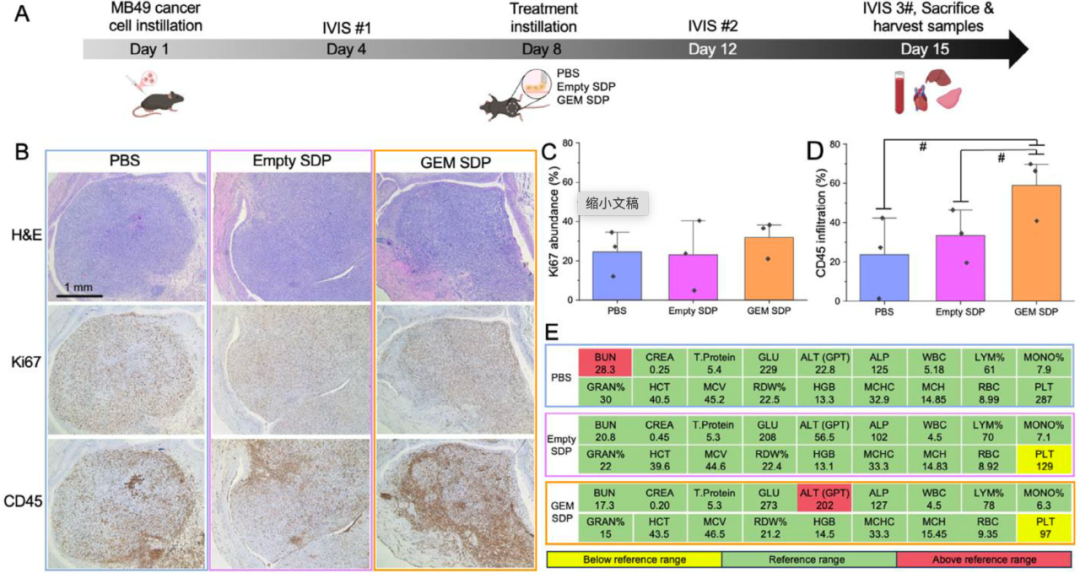
药物负载的SDPs在体内的抗肿瘤效果和毒性
从 贴地飞行 走向临床应用的
高空起跳
这项受壁虎启发的SDPs药物递送平台,堪称一次将 自然智慧 与 工程创新 完美融合的案例。它不仅有效延长药物在膀胱中的停留时间,实现了更持久、更精准的化疗药效,还因其优异的生物相容性,为未来广泛应用打开了想象空间。
展望未来,研究团队计划进一步评估SDPs在不同类型膀胱癌模型中的表现,并探索其与免疫治疗等其他疗法的协同效果。如果能将这一平台推广至其他类型的实体瘤治疗中,并通过工艺优化进一步提升包载效率和药物释放控制,那这套系统无疑将为癌症治疗注入新的活力。
总之,这一灵感源于壁虎的创新型药物递送系统,已在实验阶段展现出不俗的治疗潜力。相信随着更多研究的深入,我们离 药到病除且副作用小 的理想治疗模式,又近了一步。
