减重新靶点风暴 | ADA 2025
时间:2025-06-21
6月20日-6月23日,全球规模最大的会议 第85届美国糖尿病协会(ADA)大会将在美国芝加哥召开,来自全球各地的药企将在会上展示代谢领域创新药物的临床和临床前研究成果。
随着ADA摘要全文在近日基本公布,多款创新减肥药物的减重数据露出水面。GLP-1靶点的巨大减重潜力早已在多项研究中得到充分验证,GLP-1R激动剂也因此成为了炙手可热的赛道。但GLP-1类药物仍存在优化空间,需要解决肌肉流失等问题。医药魔方从200+项临床研究成果中梳理了8款基于创新机制的减肥药物,本文将对其研究成果进行介绍。
ADA 2025大会上的减肥新机制药物
药物:NNC0487-0111(amycretin)
药物类型:多肽GLP-1R/AMYR(胰淀素受体)激动剂
研发机构:诺和诺德
全球研发赛道排名:1/1
本次公布的Ib/IIa期研究是一项单中心、随机、双盲临床试验,评估了Amycretin(每周1次,皮下注射,n=101)对比安慰剂(n=24)在BMI为27.0-39.9kg/m2且HbA1c低于6.5%的成人受试者中的有效性和安全性。主要终点为治疗期间不良事件(TEAE)的数量。
研究分为5个部分:
Part A:单剂量递增(SAD)研究,包含0.3mg、1mg和6mg三个剂量组;
Part B:多剂量递增(MAD)研究,从0.3mg递增至60mg,治疗期为36周;
Part C:MAD研究,从0.3mg递增至20mg,总治疗期为36周;
Part D:MAD研究,从0.3mg递增至5mg,总治疗期为28周;
Part E:MAD研究,从0.3mg递增至1.25mg,总治疗期为20周。
结果显示,Amycretin剂量递增至60mg时,受试者仍然耐受。最常见的TEAE是胃肠道反应,包括恶心、呕吐和腹泻,大多数为轻度至中度。AUC和Cmax随着Amycretin剂量增加而增加。
Part B-Part E受试者的基线平均BMI为30.0-33.1kg/m2。四个队列的结果显示,相比于安慰剂组,Amycretin组受试者的体重较基线显著减轻(p 0.001)。
Part B-Part E受试者体重降幅

药物:LAE102
药物类型:ACVR2A(激活素受体IIA型)单抗
研发机构:来凯医药
全球研发赛道排名:1/1
该研究是一项随机、双盲、安慰剂对照I期临床试验(n=64),在健康受试者中评估了单剂量LAE102的安全性、药代动力学和药效学。研究分为Part A(1.1/2/4/8/16mg/kg,)和Part B(2/4/8mg/kg,皮下注射),受试者按6:2被随机分配至LAE102组或安慰剂组。
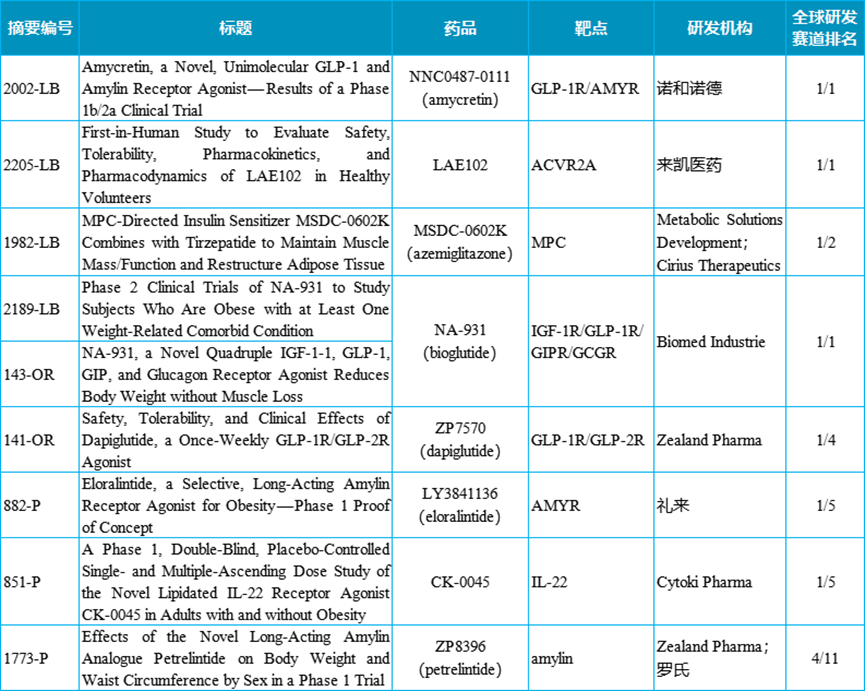
结果显示,LAE102的血清浓度呈剂量依赖性增加,表现出非线性PK和靶点介导的药物暴露特征。在所有剂量组中均观察到血清激活素A水平显著增加。随访28天时,8mg/kg(皮下注射)组、8mg/kg(静脉注射)组和16mg/kg(静脉注射)组d的激活素A水平仍然维持升高。此外,单剂量LAE102具有良好的安全性和耐受性良好,大多数TEAE是轻度、无症状的实验室指标异常。没有受试者报告导致研究终止的严重不良事件或TEAE。这些数据支持在超重或肥胖人群中进一步探索LAE102(皮下注射)的潜力。
LAE102(皮下注射)血清浓度和血清激活素A水平相对于基线的百分比变化
药物:MSDC-0602K(azemiglitazone)
药物类型:小分子MPC抑制剂
研发机构:Metabolic Solutions Development/Cirius Therapeutics
全球研发赛道排名:1/2
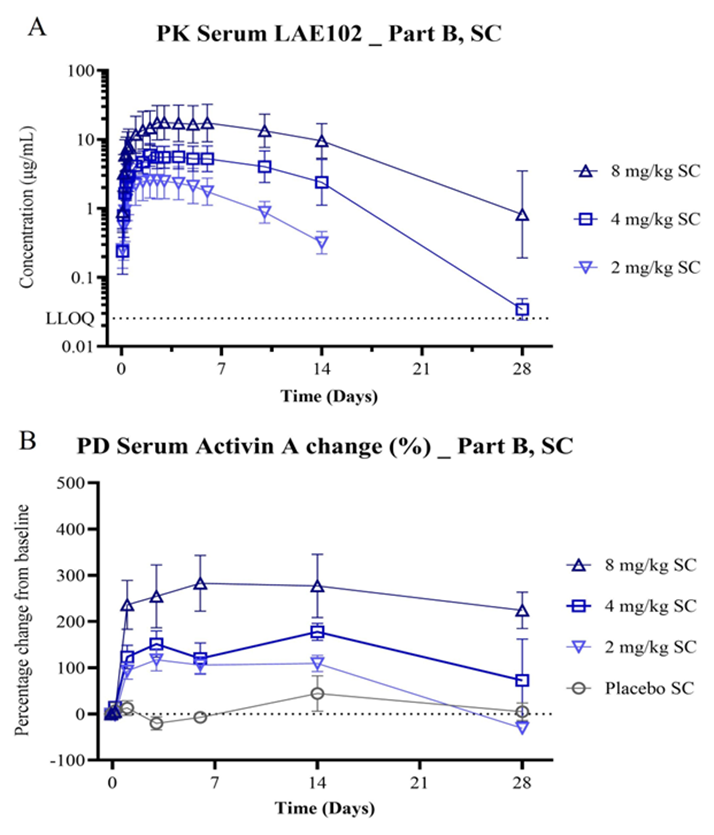
MSDC-0602K是一种新型胰岛素增敏剂,旨在优先靶向线粒体丙酮酸转运载体(MPC),同时最大限度地减少与转录因子PPAR 的直接结合,从而改善GLP-1类药物导致的潜在代谢和骨骼肌质量/功能损失问题。临床前研究显示,MSDC-0602K(30nmol/kg)联合替尔泊肽可显著减轻小鼠体重并增加肌肉质量。
在伴2型糖尿病肥胖受试者中开展的研究显示,MSDC-0602K单药组和联用替尔泊肽组受试者的内脏脂肪皮下脂肪比(visceral:subcutaneous adipose ratio)均下降,棕色脂肪组织均增加。联用组受试者的脂肪组织实现了深度重塑。
治疗3个月后,MSDC-0602K单药组受试者的胰岛素介导的葡萄糖代谢量增加了50%(通过葡萄糖钳夹技术评估),肌细胞内脂质减少了50%(通过磁共振波谱分析评估)。
药物:NA-931(bioglutide)
药物类型:口服小分子IGF-1R/GLP-1R/GIPR/GCGR激动剂
研发机构:Biomed Industrie
全球研发赛道排名:1/1
本次大会,NA-931有三项临床研究成果入选,其中两项为减重研究。
NCT06564753:一项为期13周的随机、双盲、安慰剂对照、MADII期研究,评估了NA-931(每日1次)在至少有一种与体重相关合并症的肥胖(BMI 30kg/m2)或超重(BMI 27kg/m2)成人受试者中的安全性、耐受性、减肥效果。
研究表明,NA-931组受试者的体重呈剂量依赖性减轻,150mg剂量组较基线降低了14.8%,较安慰剂组降低了13.2%。在体重减轻 5%的受试者中进行的探索性分析显示,NA-931组达到体重减轻 12%的受试者比例更高(72% vs 2%)。
安全性方面,研究中报告的TEAE微不足道或轻微。安慰剂组和NA-931组的胃肠道不良事件发生率差异没有临床意义。观察到的所有胃肠道不良事件均为微不足道(占比83%)或轻微。NA-931组受试者报告的轻度恶心和呕吐都是微不足道的。NA-931组有8.1%的受试者出现腹泻,而安慰剂组为3.2%。未观察到受试者出现肌肉损失情况。
NCT06615700:一项为期28天的随机、双盲、安慰剂对照、剂量递增I期研究(n=74),评估了NA-931在超重或肥胖受试者中以单次和多次递增剂量给药时的安全性、耐受性、药代动力学和药效学。
研究表明,在研究中,NA-931组受试者的体重呈剂量依赖性减轻,降幅最高可达6.4%。在剂量 60mg的NA-931试验组中,第35天(即最后一次给药后7天),受试者经安慰剂组调整后的体重保持减轻,较安慰剂最高减轻5.3%。在体重减轻 5%的受试者中进行的探索性分析表明,NA-931组达到体重减轻 5%的受试者比例更高(63% vs 0%)。
安全性方面,NA-931组报告的TEAE不显著或轻微。安慰剂组和NA-931组的胃肠道不良事件发生率差异没有临床意义。观察到的所有胃肠道不良事件均为微不足道(84%)或轻微。NA-931组未报告轻度恶心和呕吐。NA-931组和安慰剂组分别报告1例(2.3%)和2例(10%)腹泻。未观察到受试者出现肌肉损失情况。
药物:ZP7570(dapiglutide)
药物类型:多肽GLP-1R/GLP-2R激动剂
研发机构:Zealand Pharma
全球研发赛道排名:1/4
本次公布的Ib期研究(n=54)评估了dapiglutide在BMI为27.0-39.9kg/m 的健康受试者中的安全性、耐受性、药代动力学和药效学特征。受试者按14:4被随机分配至dapiglutide(7.5/10/13mg,每周1次,皮下注射)组和安慰剂组。每2周进行一次剂量递增,在13周的治疗期内达到目标剂量。试验期间不干预受试者的生活方式。
结果显示,在13周后,安慰剂组受试者的体重增加了2.1%。经安慰剂组校正后,7.5mg、10mg和13mg剂量组受试者的体重下降了6.7%、8.3%和7.1%。
药代动力学数据显示,dapiglutide具有剂量比例关系,3个剂量组的平均半衰期为112-119h,这些数据说明dapiglutide适合每周1次给药。dapiglutide组有14.3%的受试者在随访时检测到低滴度的抗药物抗体(ADA),但这对药代动力学、疗效或安全性没有明显影响。
此外,dapiglutide安全且耐受性良好,未报告治疗相关的严重或重度不良事件。最常见的不良事件是胃肠道疾病和代谢及营养障碍(主要是食欲减退)。大多数不良事件为轻度。dapiglutide组有2例受试者因不良事件(胃肠道不良事件)退出试验。
药物:LY3841136(eloralintide)
药物类型:多肽AMYR激动剂
研发机构:礼来
全球研发赛道排名:1/5
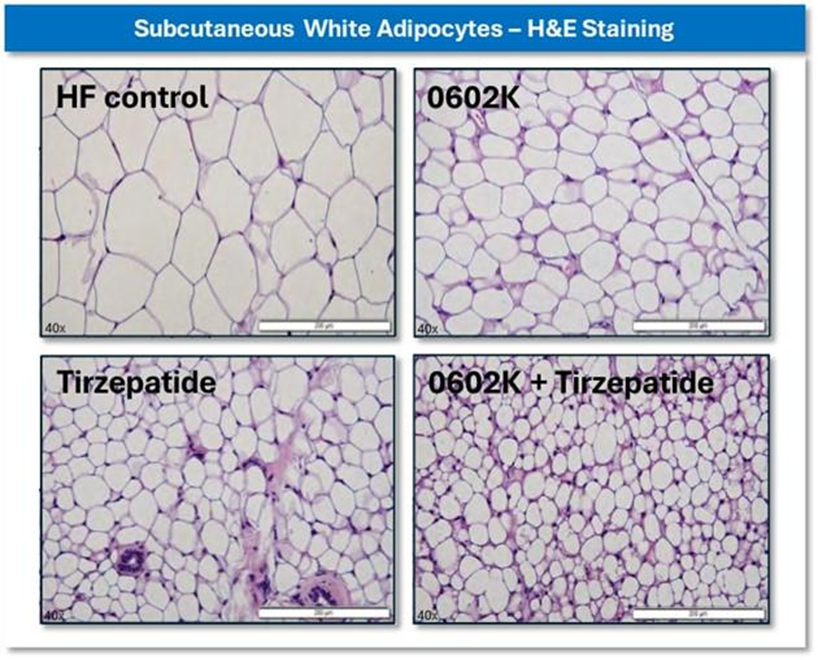
本次公布的I期研究(n=100)评估了eloralintide(4个剂量,每周1次,皮下注射)在BMI为27.0-43kg/m 的肥胖或超重受试者中的安全性、耐受性、药代动力学和药效学。
结果显示,eloralintide的平均半衰期为13.9-15.8天。在第12周,eloralintide组体重较基线的最小二乘法(LS)平均百分比变化范围为-2.6%~-11.3%。
此外,eloralintide耐受性良好,胃肠道不良事件发生率低。eloralintide组常见的TEAE为食欲减退(19%)、头痛(12%)、疲劳(11%)和新冠感染(11%)。eloralintide组的胃肠道TEAE发生率较低,包括腹泻(10%)、恶心(8%)和呕吐(4%)。大多数TEAE为轻度。未发生死亡事件,发生1例(4%)与eloralintide无关的严重不良事件。
药物:CK-0045
药物类型:IL-22类似物
研发机构:Cytoki Pharma
全球研发赛道排名:1/5
本次公布的I期研究评估了CK-0045在健康受试者(肥胖与非肥胖)中的安全性、耐受性和药代动力学特征。在SAD部分,40例健康受试者按3:1被随机分配至5个队列,接受CK-0045(1-30 g/kg,皮下注射)或安慰剂治疗。在MAD部分,36例肥胖健康受试者(BMI为30.0-39.9kg/m )按3:1被随机分配至CK-0045(1.25/2.5/5 g/kg,每周1次,皮下注射)组或安慰剂组,持续6周。
结果显示,CK-0045在所有剂量下均显示出良好的安全性,且在SAD部分剂量高达10 g/kg、MAD部分剂量高达2.5 g/kg时耐受性良好。所有不良事件均为轻度或中度,其中皮肤干燥、嘴唇干燥和瘙痒是最常报告的药物相关不良反应。实验室检查、心电图或生命体征方面未见具有临床意义的不良趋势。
CK-0045的药物暴露量和靶点诱导的生物标志物水平呈剂量依赖性增加。第6周体重减轻并非剂量依赖性,但按CK-0045暴露量三分位数分析时,显示出暴露量-剂量比例关系(+0.8%、-1.1%和-1.6%)。最高暴露量三分位数组的体重降幅显著高于安慰剂组(-0.3%)(p=0.04)。此外,还观察到水平显著降低,以及多个其他代谢参数显示出非显著性疗效信号。
药物:ZP8396(petrelintide)
药物类型:amylin类似物
研发机构:Zealand/罗氏
全球研发赛道排名:4/11
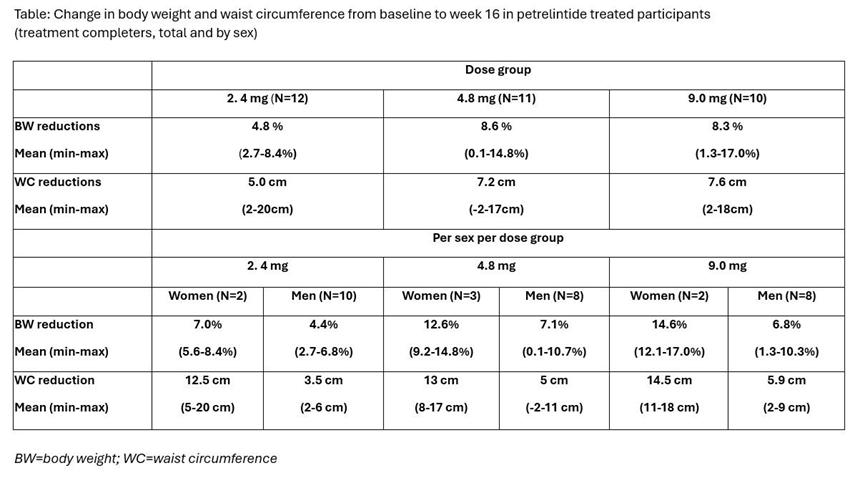
本次公布的I期研究(n=48)评估了petrelintide(每周1次,皮下注射)在超重或肥胖健康受试者中的减重效果。基线时,受试者的平均BMI为29kg/m ,平均体重为92kg,平均腰围为102cm。受试者按3:1被随机分配至petrelintide(2.4/4.8/9.0mg)组或安慰剂组,治疗16周。
结果显示,与合并安慰剂组相比(体重减少1.7%,腰围减少1.9cm),petrelintide三个剂量组的体重分别下降4.8%、8.6%、8.3%,腰围分别减少5.0cm、7.2cm、7.6cm。在三个剂量队列中,女性治疗效果均更为显著。
同时,petrelintide保持了良好的耐受性,胃肠道不良事件发生率较低,仅1例受试者因胃肠道不良事件停药。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
