Sci Adv:武汉大学刘胡丹/卿国良等合作发现FTO调控ELK3介导的代谢重编程并作为T细胞白血病的独特治疗靶点
时间:2025-06-08

T细胞急性淋巴细胞白血病(T-ALL)是一种致命的侵袭性血液系统恶性肿瘤,其特征为未成熟胸腺细胞的异常增殖,可累及儿童及成人患者。尽管通过强化多药联合化学治疗方案已使儿童患者总生存率(OS)达到80%,但该疗法常伴随显著的短期与长期副作用。而成人T-ALL患者因治疗相关毒性更高,其总生存率不足50%。相当比例患者面临疾病复发的挑战,其中化学治疗耐药病例预后尤为不良。这些临床难题凸显了实施靶向治疗的迫切需求。分子遗传学分析与测序研究已鉴定出参与T-ALL发展的遗传学异常,但目前临床获批的靶向治疗方案仍十分有限,这要求我们更深入理解其分子发病机制以开发有效治疗策略。
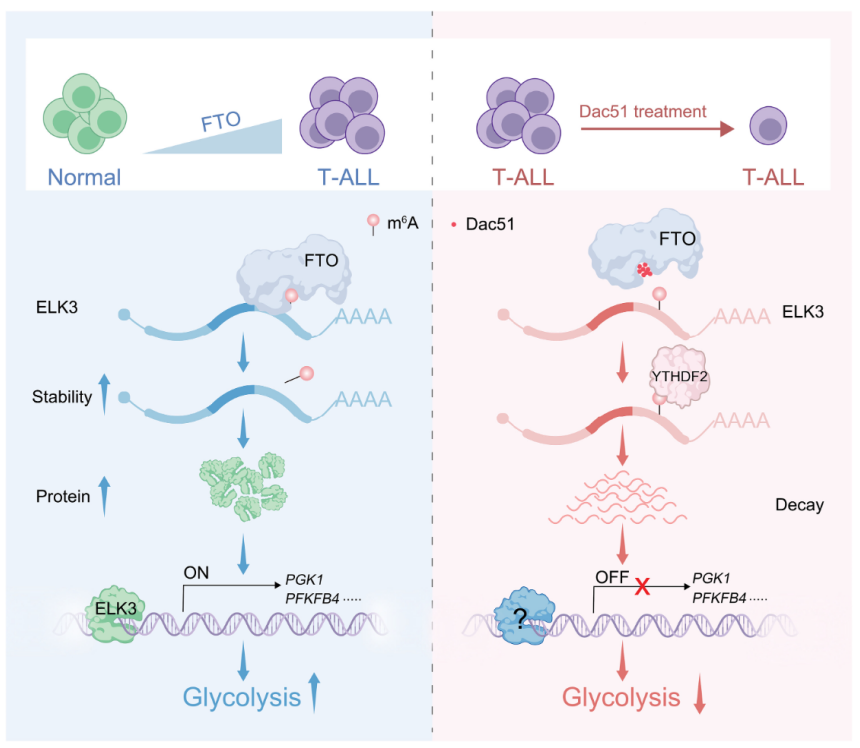
模式机理图(图片源自Science Advances)
N6-甲基腺苷(m6A)是信使RNA(mRNA)中最主要的内部修饰,可在转录后水平调控基因表达。该修饰由甲基转移酶样蛋白3(METTL3)-甲基转移酶样蛋白14(METTL14)-Wilms肿瘤1相关蛋白(WTAP)甲基转移酶复合物催化形成,并可被去甲基化酶alkB同源蛋白5(ALKBH5)或脂肪质量与肥胖相关蛋白(FTO)可逆性去除。这种修饰通过影响RNA代谢的多个环节(包括调控mRNA稳定性及翻译效率)在决定修饰后RNA分子命运中起关键作用。因此,RNA m6A修饰被视为重要的基因表达表观遗传调控机制,参与包括肿瘤在内的多种病理生理过程。现有实验证据表明,m6A整体丰度及甲基化酶/去甲基化酶表达水平在人类肿瘤中普遍失调,这些因素对肿瘤发生发展至关重要。然而,m6A调控因子在T-ALL中的功能意义尚未明确。
本研究系统分析了原发性T-ALL样本中m6A修饰酶相关基因,发现去甲基化酶FTO与ALKBH5在转化胸腺细胞中表达升高,提示RNA m6A去甲基化在T细胞白血病发生中起重要作用。为验证该假说,我们采用T细胞特异性基因敲除小鼠模型(缺失Fto或Alkbh5)构建NOTCH1驱动的T-ALL,发现白血病发生严格依赖FTO 敲除FTO(而非ALKBH5)可显著阻断T-ALL的起始与进展。多组学整合分析鉴定出ELK3作为FTO关键下游靶标:FTO介导的ELK3 mRNA m6A去甲基化可增强其稳定性,导致ETS结构域蛋白ELK3水平升高,进而激活糖酵解相关基因(如磷酸甘油酸激酶1(PGK1))的转录,最终促进T-ALL糖酵解过程。鉴于多种FTO抑制剂已进入临床研究阶段,本研究提示这些小分子药物或可应用于T细胞白血病治疗。
原文链接:
https://doi.org/10.1126/sciadv.adq3052
