Cancer Discovery :胶质母细胞瘤皮质类器官显示恶性向非恶性细胞频繁的物质转移
时间:2024-11-01

该团队首先将GFP标记的患者来源的胶质母细胞瘤细胞移植到人类皮质类器官中,植入后2周,GFP标记的细胞充分浸润并形成经典结构如肿瘤微管和细胞外囊泡。理论上,应该仅能在GFPpos中发现恶性细胞,但该团队还在GFPpos中意外地观察到大量非恶性细胞,其中约17%内检测到GFP转录物,提示可能存在从恶性细胞到非恶性细胞的物质转移。通过对GFPpos和GFPneg非恶性细胞之间的差异表达基因进行分析,发现在GFPpos非恶性细胞中独特且高度上调的基因同样在AC样和MES样亚型中强烈富集。
该团队假设细胞外囊泡(EVs)可能是GCO中mRNA/蛋白质的转运机器,于是利用尺寸排阻色谱分离出EVs并进行RNA-seq,结果显示EVs中的恶性转录本与GCO恶性细胞之间存在高度相关性,支持EVs至少是一种潜在的mRNA转移机制。最后,为确认EVs介导的mRNA转移可能发生在其他类型的癌症中,该团队将GFP标记的细胞植入皮质类器官中,并在两周后经流式分选出GFPpos和GFPneg细胞,同样在非恶性细胞中检测到了GFP转录本,证实该转移机制可能普遍存在于多种癌症中。
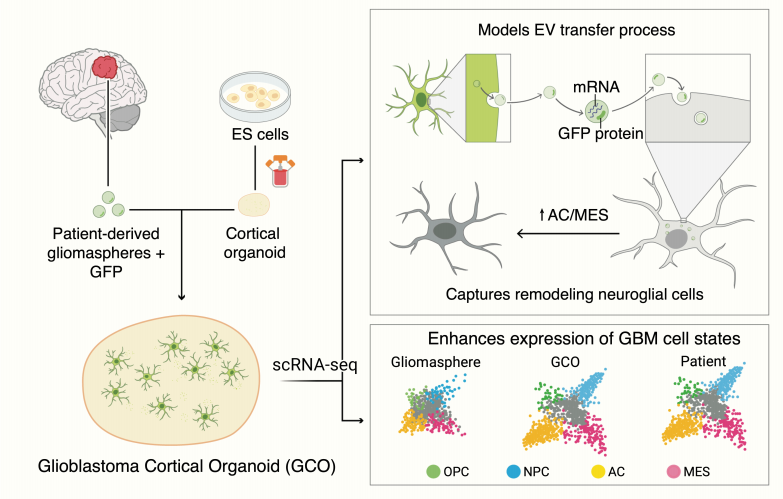
模式图(Credit:Cancer Discovery)
综上,这项工作不仅开发了用于剖析人类胶质母细胞瘤的肿瘤异质性和细胞间通讯的GCO模型,还证明了恶性肿瘤细胞可将转录本频繁转移至非恶性细胞中,但其功能意义仍然未知,因此,未来还需进一步探索这种转移对肿瘤微环境的影响。
