上海大学发表最新Cell子刊论文
时间:2025-08-23
来源:生物世界 2025-08-23 11:50
该研究开发了一种仿生纳米疫苗,通过诱导泛凋亡(PANoptosis)并重塑促结缔组织增生的肿瘤微环境,激发强效抗肿瘤免疫、降低复发风险并抑制转移。基于树突状细胞(DC)的疫苗在实体瘤中的应用仍临着一些重大挑战,包括实体瘤缺少肿瘤特异性抗原以及实体瘤中的抑制性间质。
2025 年 8 月 21 日,上海大学陈雨教授团队联合同济大学附属第十人民医院丁利研究员、复旦大学附属肿瘤医院Huang Lili等人,在 Cell 子刊Cell Reports Medicine上发表了题为:Biomimetic nanoimmunotherapy boosts spatiotemporal PANoptosis and reshapes desmoplastic tumor microenvironment的研究论文。
该研究开发了一种仿生纳米疫苗,通过诱导泛凋亡(PANoptosis)并重塑促结缔组织增生的肿瘤微环境,激发强效抗、降低复发风险并抑制转移。

癌症免疫疗法利用免疫系统对抗肿瘤,已成为癌症治疗领域的一种变革性方法。在众多策略中,基于树突状细胞(DC)的疫苗通过将肿瘤抗原或 mRNA 加载到树突状细胞上,展现出激发抗肿瘤免疫反应和激活抗原特异性 T 细胞的潜力。
然而,传统的树突状细胞疫苗由于缺乏肿瘤特异性抗原、体内抗原降解以及免疫耐受等难题,在临床上取得的成功有限。为解决这一问题,已开发出通过将树突状细胞与融合而形成的杂交细胞,以将肿瘤抗原性与树突状细胞介导的 T 细胞活化相结合。
虽然这些杂交细胞能够归巢至淋巴器官以增强抗原呈递,但它们也存在致以及与保存和运输相关的物流难题。因此,研究人员探索了诸如树突状细胞与肿瘤融合细胞膜疫苗之类的替代策略,显示出强烈的免疫反应,但受到慢性抗原暴露和免疫抑制性肿瘤微环境(TME)的限制。
值得注意的是,实体瘤中的促结缔组织增生性间质对免疫细胞浸润构成物理屏障,进一步阻碍了疫苗的效果。为了克服这些障碍,需要一种既能增强基于树突状细胞的疫苗效力,又能应对免疫抑制性肿瘤微环境挑战的方法。
一个有前景的方法是诱导免疫原性细胞死亡(ICD),特别是PANoptosis(本文翻译为泛凋亡),这是一种新兴的炎症性程序性细胞死亡方式,其结合了焦亡(Pyroptosis)、凋亡(Apoptosis)和性凋亡(Necroptosis)的关键特征,并因此得名。
利用泛凋亡与树突状细胞/肿瘤融合膜疫苗相结合,能够将疫苗的免疫刺激作用与炎症细胞死亡对肿瘤微环境的改变作用协同起来。这种双重作用策略既能增强细胞毒性 T 淋巴细胞(CTL)的活化,又能重新编程肿瘤微环境(TME),从而克服免疫抑制和物理屏障。尽管该方法潜力巨大,但原位诱导泛凋亡的策略仍处于发展不足的状态,尤其是在癌症疫苗纳米技术的背景下。
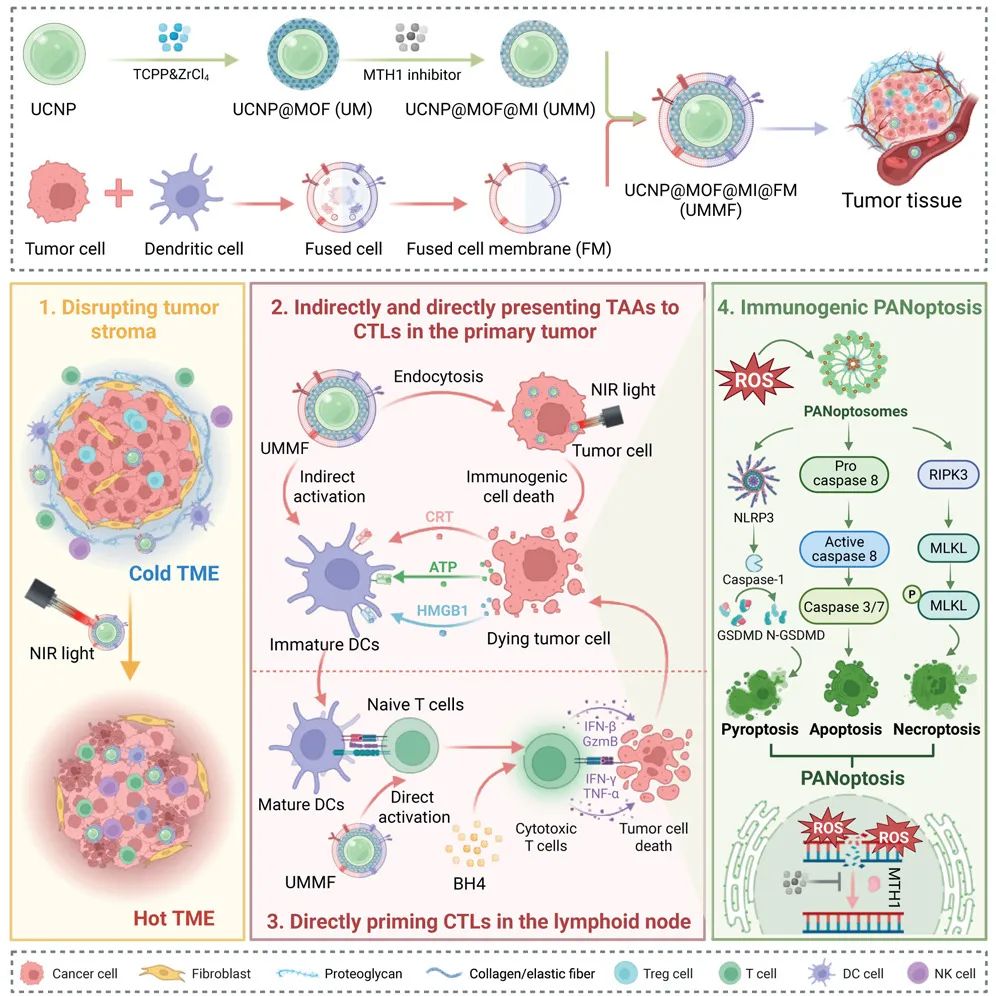
在这项最新研究中,研究团队开发了一种治疗性纳米疫苗 UCNP@MOF@MI@FM(简称为 UMMF),其由包裹了树突状细胞与肿瘤融合细胞膜的UCNP@MOF 纳米颗粒构成,这些纳米颗粒共负载了 MTH1 抑制剂,并与四氢生物蝶呤(BH4)结合。
该融合膜可实现肿瘤和淋巴结的双重靶向,同时支持广谱肿瘤抗原的呈递。在近红外(NIR)照射下,上转换效应触发的活性氧(ROS)生成与 MTH1 抑制作用协同诱导免疫原性的泛凋亡(PANoptosis),释放出抗原并促进树突状细胞(DC)成熟。同时,活性氧通过降解胶原蛋白和耗竭癌症相关成纤维细胞(CAF)来重塑肿瘤间质,增强 T 细胞浸润。BH4 可拮抗吲哚胺2,3-双加氧酶(IDO)介导的犬尿氨酸积累,逆转免疫耐受并恢复 T 细胞功能。
这一多功能平台整合了肿瘤细胞杀伤、免疫启动及实体瘤基质重编程功能,从而激发强效抗肿瘤免疫、降低复发风险并抑制转移。UMMF 通过可控的泛凋亡及微环境调控,为纳米免疫治疗提供了前景广阔的策略。
该研究的核心发现:
仿生纳米疫苗时空触发活性氧诱导的免疫原性泛凋亡;
近红外光编程疗法重塑免疫抑制性肿瘤微环境;
BH4 与 UMMF 纳米疫苗的协同作用可对抗免疫治疗耐受性。