因涉嫌性骚扰被开除,mTOR研究先驱远走捷克从新建立实验室,如今再发Nature
时间:2025-08-22
来源:生物世界 2025-08-22 10:18
研究团队表示,目前基于人工智能(AI)的蛋白质结构预测工具尚无法充分模拟营养传感器在配体或 GATOR2 结合时发生的构象变化。David Sabatini,1968 年出生于美国纽约,因mTOR相关研究而闻名世界。1994 年,在博士期间,他发现了 mTOR 蛋白,并揭示了它是雷帕霉素的直接作用靶点。1997 年博士毕业后,他加入了麻省理工学院 Whitehead 研究所,建立了自己的实验室,2006 年拿到终身教职,2008 年入选 HHMI 研究员,2016 年当选美国国家科学院院士(时年48岁)。
年少成名的David Sabatini,科研生涯可谓一帆风顺,对mTOR 的功能、调控及其在癌症等疾病中的作用做出了众多关键贡献。迄今为止,他发表了超过 200 篇论文,其中有超过 70 篇论文发表于Cell、Nature、Science三大顶刊,论文总被引次数超过 19万,H 指数高达 160。
而这些荣誉与辉煌,在 2020 年 10 月戛然而止。一位女性研究员向麻省理工学院 Whitehead 研究所的新任所长投诉,称David Sabatini对其进行了性骚扰。2021 年 8月,David Sabatini被迫从麻省理工学院 Whitehead 研究所辞职,并被资助其科研经费的 HHMI 解雇。
不久后,David Sabatini向法院起诉了指控自己性骚扰者和麻省理工学院 Whitehead 研究所所长 Ruth Lehmann,他在给法庭的文件中称自己是这起虚假指控的受害者,自己是被报复性指控。而这起虚假指控摧毁了自己的专业和个人声誉,也结束了自己卓越的科研生涯。
2022 年 5 月,纽约大学计划聘用David Sabatini,但因遭到部分学生或教职员工的抗议而未果。
在美国难以继续进行研究工作的David Sabatini于 2023 年 11 月接受了捷克科学院的职位,在捷克科学院有机化学与生物化学研究所建立了新的实验室,继续进行 mTOR 相关研究。
2025 年 8 月 20 日,David Sabatini团队与斯坦福大学医学院Kacper Rogala团队合作,在国际顶尖学术期刊Nature上发表了题为:Structural basis for the dynamic regulation of mTORC1 by amino acids的研究论文。该研究解析了氨基酸动态调控mTORC1 的结构基础。

mTORC1是一种蛋白复合体,在细胞生长、代谢和生存的调控中发挥着核心作用,该复合体由mTOR、Raptor、mLST8、PRAS40 和DEPTOR 组成。其中mTOR 作为复合体的催化核心,是雷帕霉素(rapamycin)的靶点;Raptor 作为支架蛋白,与 mTOR 结合参与调控蛋白质合成;mLST8 调节复合体稳定性,参与能量代谢调控;PRAS40 通过与 Raptor 结合抑制复合体活性;DEPTOR 作为调控蛋白参与复合体组装与功能调控。
氨基酸通过Rag GTP 酶激活mTORC1,而 Rag GTP 酶的活性受GATOR 超级复合体调控,该超级复合体由 GATOR1、KICSTOR 和营养感知枢纽GATOR2组成。
GATOR2 形成一个八角形笼状结构,其独特的WD40 结构域 -螺旋桨可与 GATOR1、亮氨酸传感器Sestrin1/Sestrin2(SESN1/SESN2)以及精氨酸传感器CASTOR1相互作用。这些传感器如何调控 GATOR2?它们结合相应氨基酸后又如何脱离 GATOR2?这些机制仍未被阐明。
在这项最新研究中,研究团队通过冷冻电镜技术解析了稳定态的 GATOR2 分别与 Sestrin2 或 CASTOR1 结合时的复合体结构。结果显示,两种传感器占据独特且互不重叠的结合位点,破坏这些位点将选择性损害 mTORC1 对特定氨基酸的感知能力。
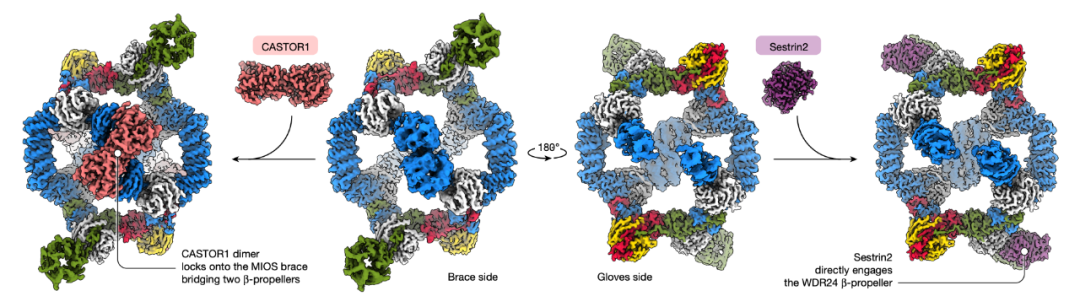
sc-GATOR2、sc-GATOR2-Sestrin2 和 sc-GATOR2-CASTOR1 复合体的结构
该研究还解析了 Sestrin2 的空载状态(不与亮氨酸结合)结构,并表征了亮氨酸/精氨酸诱导的 Sestrin2 和 CASTOR1 结构重排 这些变化触发它们与 GATOR2 的解离。
传感器的结合会限制 GATOR2 中WDR24 的 -螺旋桨结构域的动态性(该结构域是营养依赖性 mTORC1 激活的关键)。
基于上述发现,研究团队揭示了两个层级的调控机制
别构信号传递:氨基酸充足性信号通过传感器传递至 GATOR2;
结构驱动激活:GATOR2 的构象变化最终导致 mTORC1 激活。
最后,研究团队表示,目前基于人工智能(AI)的蛋白质结构预测工具尚无法充分模拟营养传感器在配体或 GATOR2 结合时发生的构象变化。预计对 GATOR 复合体(包括其未解决的组分 KICSTOR 和调控因子 SAMTOR)进行实验结构测定,对于揭示 mTORC1 营养感知通路的调控逻辑以及理性设计调控其功能的药物至关重要。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
