2025年7月Cell期刊精华
时间:2025-07-29
2025年7月份已经结束,7月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.
DOI: 10.1016/j.cell.2025.06.037
是什么让人类大脑与众不同? 一项发表在《细胞》杂志上的新研究鉴定出了两个与人类大脑特征相关的基因,并为发现更多此类基因提供了路线图。这项研究可能有助于深入了解人类大脑的功能和进化,以及语言障碍和自闭症的根源。
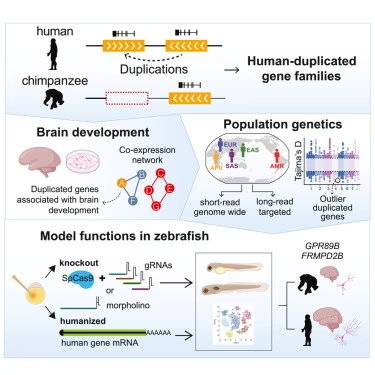
Dennis 及其同事们使用端粒到端粒人类基因组来识别重复基因(duplicated genes)。然后,他们根据千人基因组计划(1000 Genomes Project)的序列,筛选出那些:在大脑中表达、存在于所有人类中、且是保守的(conserved)(即它们在个体间没有表现出太大变异)的基因。
他们筛选出了大约250个候选基因家族。从中,他们挑选了一些在动物模型斑马鱼(zebrafish) 中进行进一步研究。通过剔除基因和将人类重复基因引入斑马鱼,他们证明其中至少有两个基因可能促成人类大脑特征:一个名为 GPR89B 的基因导致脑容量略微增大,另一个名为 FRMPD2B 的基因导致突触信号传导(synapse signaling)改变。
2.
DOI: 10.1016/j.cell.2025.06.023
人类T细胞病毒1型(Human T-cell leukemia virus type 1, HTLV-1)与HIV病毒一样感染相同的细胞类型,即T细胞。T细胞是一种血液细胞,帮助身体抵抗感染。一小部分感染HTLV-1的人在感染很长时间后会出现严重的疾病,如成人T细胞白血病(adult T-cell leukemia)和脊髓炎症(spinal cord inflammation)。然而,这仍然是一种人们知之甚少的疾病,目前既没有预防性治疗,也没有治愈方法。
不过,一项具有里程碑意义的新研究可能改变这一现状。来自美国和澳大利亚的研究人员确定了一个新的药物靶点,有望清除已感染者体内的HTLV-1阳性细胞,并阻止疾病进展。他们还发现,现有的HIV药物可以在小鼠模型中抑制HTLV-1病毒的传播。这一发现可能催生首个预防这种病毒传播的治疗方法。相关研究结果发表在《细胞》杂志上。
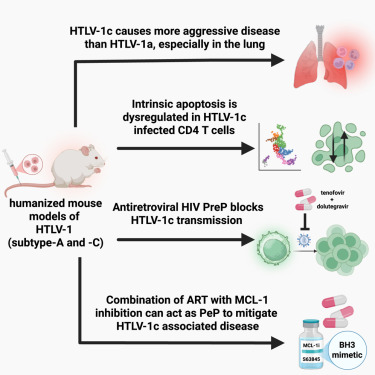
在这项跨越10年的研究努力中,该研究团队分离了这种病毒,并开发了世界首个感染HTLV-1的人源化小鼠模型(humanized mouse model)。这使他们能够研究该病毒在具有类似人类免疫系统的活体生物中如何作出表现。
这些小鼠被移植了对HTLV-1(包括澳大利亚独特的基因型HTLV-1毒株,即HTLV-1c)感染敏感的人类免疫细胞。国际毒株HTLV-1a和澳大利亚毒株HTLV-1c在这些具有人类免疫系统的小鼠中均能引起白血病和炎症性肺病。随后,这些小鼠接受了泰诺福韦(tenofovir)和度鲁特韦(dolutegravir)的治疗 这是目前批准用于抑制HIV和预防AIDS的两种抗病毒疗法。该团队发现这两种药物也能有效抑制HTLV-1。
在另一项重要的发现中,该团队发现,当这些小鼠接受HIV药物联合另一种抑制MCL-1蛋白(已知有助于异常细胞存活)的疗法治疗时,含有HTLV-1的人类细胞可以被选择性杀死。
该团队如今正在利用RNA疗法(precision RNA therapies)开发靶向MCL-1的新方法,并建立可进行临床测试的联合治疗方案。他们相信这可能为HTLV-1提供一种有前景的治愈策略。
3.
DOI: 10.1016/j.cell.2025.07.001
隐孢子虫入侵并在肠道上皮细胞内繁殖,引起严重腹泻。这对流行地区的儿童和免疫系统较弱的人来说尤其危险。尽管它对全球公共卫生有重大影响,但目前尚无完全有效的治疗方法。这种寄生虫入侵者通过操纵生物途径并劫持宿主的代谢,进化出在人类肠道中生存的能力。如今,在一项新的研究中,Adam及其团队开发了一种方法来绘制这种复杂的生存路线图,并切断隐孢子虫最重要的生命线。相关研究结果发表在《细胞》杂志上。
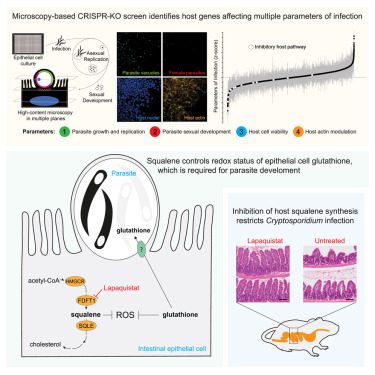
他们使用CRISPR基因编辑技术进行了一项全基因组规模的筛选实验,系统地逐一关闭人类肠道细胞中近20,000个蛋白质编码基因。他们然后用隐孢子虫感染这些细胞,观察每个基因如何影响这种寄生虫的生存。
人类控制氧化应激的主要方式是通过一种名为谷胱甘肽(glutathione)的分子。这种抗氧化剂对于限制氧化损伤至关重要,几乎所有生物体都有能力制造它。令人惊讶的是,该团队发现,虽然隐孢子虫使用谷胱甘肽,但它无法自己制造。这使得这种寄生虫依赖于肠道细胞提供的谷胱甘肽,并且特别容易受到氧化应激的影响。
在确定了这种关键的生存途径后,该团队随后寻找切断这条生命线的方法。当筛选靶向合成的药物时,他们发现了一种先前被放弃的药物,该药物显示出前景,因为它能直接阻断角鲨烯的产生。当给感染了隐孢子虫的小鼠使用这种名为拉帕司他(lapaquistat)的药物时,它减轻了感染并阻止了进一步的肠道损伤。
4.
DOI: 10.1016/j.cell.2025.06.048
在癌症研究中,每当科学家想测试一种新药的效果,往往需要经历漫长的细胞培养、动物实验,成本高昂且周期漫长。
而如今,一项发表在《细胞》(Cell)杂志上的突破性研究,或许能改变这一现状 来自印第安纳大学、约翰霍普金斯大学医学院等机构的团队开发出一套 "细胞行为语法",让计算机能像理解人类语言一样细胞动态,在虚拟环境中构建 "数字孪生" 细胞实验室,提前模拟从肿瘤生长到大脑皮层形成的复杂过程。
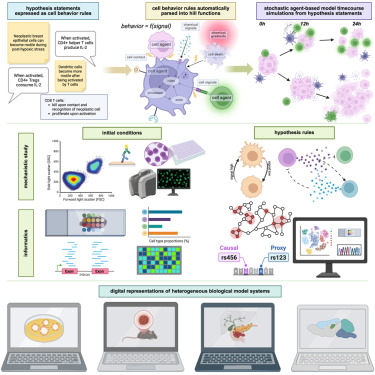
过去,用计算机模拟细胞行为是个"技术活"。即便是简单的肿瘤生长模型,也需要研究者精通数学方程和编程代码,往往数月才能完成建模。而新研究的核心突破,是为细胞行为制定了一套"人类可读语法" 就像用自然语言写句子一样,科学家只需输入 "氧气减少会让变得更具运动性" 这类规则,程序就能自动将其转化为数学模型,驱动虚拟细胞的行为。
这套语法构建在名为 PhysiCell 的开源软件框架上。软件中的"代理"(agents)就像一个个"数字细胞",它们遵循的规则映射了真实细胞的 DNA、RNA 指令,能模拟细胞分裂、迁移、与其他细胞或药物的相互作用等复杂行为。例如,在模拟肿瘤微环境时,"代理" 可以根据氧气浓度变化切换状态:低氧时变得更具侵袭性,高氧时则恢复静止。
"过去编写模型代码需要数月,现在两小时就能教会生物学家搭建基础免疫学模型。"印第安纳大学工程学教授 Paul Macklin 表示。更关键的是,这套语法能直接对接单细胞测序、空间转录组学等数据,让虚拟模型与真实组织的细胞分布、功能高度匹配。
5. 跨界 发力!Cell:两种老药组合有望逆转记忆衰退
DOI: 10.1016/j.cell.2025.06.035
阿尔茨海默病(AD)作为最常见的类型,正困扰着全球数千万人。这种疾病以大脑中 淀粉样蛋白(A )沉积、tau 蛋白缠结以及神经元和胶质细胞功能异常为特征,导致患者认知能力持续衰退。然而,过去数十年的研究仅产出少数对症治疗药物,无法真正阻断或逆转疾病进程。
近日,发表在《细胞》杂志上的一项突破性研究带来了新希望:来自加州大学旧金山分校和格拉德斯通研究所的团队发现,两种已获批的抗癌药物 来曲唑(letrozole)和伊立替康(irinotecan)的组合,能精准靶向 AD 患者大脑中不同细胞类型的异常基因表达,在动物模型中显著减少病理损伤并恢复记忆。这一 老药新用 的发现,为复杂的 AD 治疗开辟了精准联合疗法的新路径。
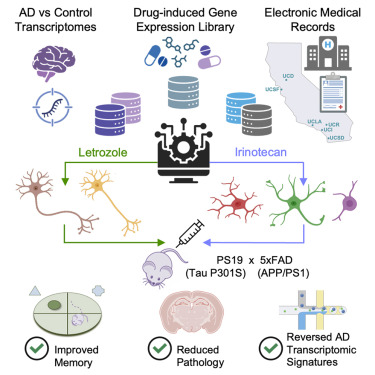
研究的起点,是解析 AD 对大脑细胞的分子影响。团队整合了三项公开研究的单细胞转录组数据,涵盖多名 AD 患者和健康对照者的大脑样本,系统分析了 6 种关键细胞类型(兴奋性神经元、抑制性神经元、小胶质细胞、星形胶质细胞、少突胶质细胞、少突胶质前体细胞)的基因表达变化。结果发现,AD 不仅会改变神经元的基因活性,胶质细胞的炎症反应、代谢紊乱等也参与其中,且不同细胞的异常基因特征差异显著。
基于这些细胞特异性的基因 异常图谱 ,研究人员对 1300 种已获批药物进行了筛选 他们对比了每种药物在人类细胞中诱发的基因表达变化,寻找能 逆转 AD 异常特征的候选。最终,86 种药物被初步锁定,其中 25 种能同时影响多种细胞类型。
为进一步验证,团队查阅了加州大学系统 140 万份 65 岁以上人群的电子病历,分析这些药物与 AD 发病风险的关联。结果显示,5 种药物与 AD 风险降低显著相关,其中来曲唑(常用于治疗)和伊立替康(常用于治疗)表现突出:服用来曲唑的人群 AD 相对风险大幅降低,伊立替康使用者风险降低更为明显。更关键的是,来曲唑主要靶向神经元的异常基因表达,伊立替康则针对胶质细胞,二者互补性强。
6.
DOI: 10.1016/j.cell.2025.06.038
在基因治疗领域,一项足以震动学界与患者群体的成果于近日诞生。来自杰克逊实验室(JAX)、布罗德研究所和非营利组织 RARE Hope 的科研精英们携手合作,实现了一次具有里程碑意义的医学探索 通过单次注射,在小鼠大脑中直接编辑 DNA,成功修正了导致一种超罕见疾病的基因突变。相关研究成果发表于顶尖学术期刊《细胞》(Cell)杂志,为众多深受神经系统疾病折磨的患者点亮了希望之光。
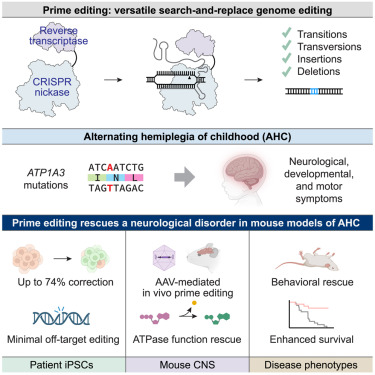
儿童交替性偏瘫(AHC),一种极其罕见且严重的神经疾病,常在婴儿期悄然来袭,给患病儿童及其家庭带来无尽痛苦。其症状表现极为残酷,突然发作的瘫痪如同 定时炸弹 ,每次发作可持续数分钟甚至数天之久。在瘫痪发作期间,患儿还常伴有肌障碍,肌肉僵硬不受控制,眼球运动也出现严重问题,发育进程更是远远落后于同龄人。癫痫发作作为疾病的 致命伴侣 ,时刻威胁着患儿的生命安全。目前,医学手段仅能有限地缓解症状,AHC 依旧是一座难以攻克的 顽疾堡垒 ,尚无治愈之法。
研究人员将目光聚焦于 AHC 的 罪魁祸首 ATP1A3 基因中的两个最常见突变 D801N 和 E815K。为深入探究和测试治疗方案,Cathleen (Cat) Lutz 精心开发了新型小鼠模型。此前,尝试在小鼠中引入这些突变,结果导致小鼠出现与人类 AHC 高度相似的严重缺陷,且过早地自发死亡,这一模型为此次研究提供了极为宝贵的实验载体。
科研团队对两种先进的下一代技术展开测试,旨在纠正基因改造 AHC 小鼠的突变。其中一种是广为人知的基因疗法,即向体内添加有缺陷基因的健康副本;另一种则是新兴的先导编辑技术。令人惊喜的是,先导编辑在这场 技术较量 中脱颖而出,展现出强大的适用性。它如同一位精准的 基因手术师 ,能够对 DNA 碱基进行编辑,成功修复了高达 85% 的脑细胞中的致病基因突变。这一成果直接带来了一系列积极改变:脑细胞中正常的蛋白质功能得以恢复,小鼠的运动技能显著改善,癫痫样发作次数大幅减少,生存期也得以明显延长。
7.
DOI: 10.1016/j.cell.2025.06.014
在一项新的研究中,由中国科学院遗传与发育生物学研究所的高彩霞(Gao Caixia)教授领导的一个研究团队开发了一种可能彻底改变蛋白质工程领域的全新方法。这种名为 人工智能辅助蛋白质工程约束(AI-informed Constraints for protein Engineering, AiCE) 的新方法,通过将结构和进化约束整合到一种通用逆折叠模型中,实现了蛋白质的快速高效进化 且无需训练专门的人工智能(AI)模型。这一发现解决了传统蛋白质工程技术面临的诸多挑战。相关研究结果发表在《细胞》杂志上。
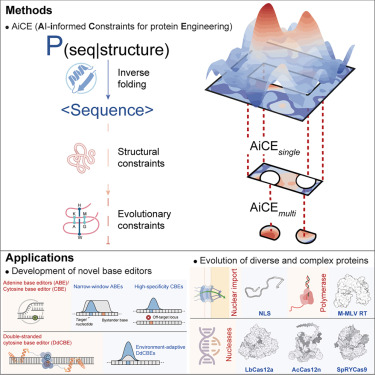
理想的蛋白质工程策略应以最小的努力实现最佳性能。然而,现有方法在成本、效率和可扩展性方面往往存在局限性。当前基于人工智能的蛋白质工程方法通常计算密集型,这凸显了需要更易于访问且用户友好的替代方案,以保持预测准确性并促进研究界更广泛的应用。
在这项研究中,研究人员首先开发了AiCEsingle,一个用于预测高适应性(HF)单氨基酸替换的模块。该模块通过广泛采样逆折叠模型(基于蛋白质三维结构生成兼容氨基酸序列的人工智能模型)并整合结构约束,提升了预测准确性。
针对60个深度突变扫描(DMS)数据集的基准测试表明,AiCEsingle相较于其他人工智能方法的性能提升了36%至90%。其对复杂蛋白质及蛋白质-核酸复合物的有效性也得到了验证。值得注意的是,仅整合结构约束即可使准确性提升37%。
8.
DOI: 10.1016/j.cell.2025.06.024
在一项新的研究中,来自麻省理工学院(MIT)及其他机构的研究人员发现了一类能够通过激活宿主细胞内的一种防御通路来抵御病毒感染的化合物。他们认为,这些化合物有望作为抗病毒药物,不仅针对某一种病毒,而是对任何类型的病毒都有效。相关研究成果发表于《细胞》杂志。
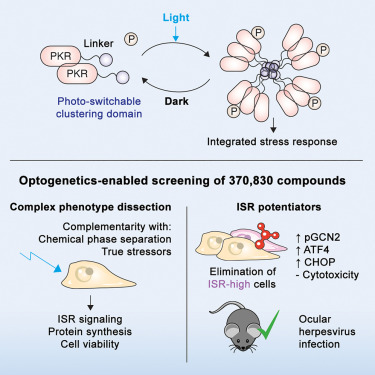
研究人员在对近40万种分子进行筛选时,发现了这些能够激活宿主细胞防御系统(即整合应激反应通路)的化合物。在人体细胞实验中,他们证明这些化合物能帮助细胞抵御呼吸道合胞病毒(RSV)、病毒和寨卡病毒的感染。它们在小鼠模型中对抗疱疹病毒感染也显示出有效性。
他们计划进一步测试这些化合物对其他病毒的活性,以期将其开发为临床试验候选药物。论文共同通讯作者、麻省理工学院医学工程与科学研究所医学工程与科学教授James Collins说道, 我们对这项研究感到非常兴奋,它使我们能够利用宿主细胞的应激反应,找到识别和开发广谱抗病毒药物的方法。
9.
DOI: 10.1016/j.cell.2025.06.028
当电活动在脑内传播时,其运动方式如同池塘中的涟漪。这些 脑电波 的运动轨迹首次于20世纪20年代被观察到。如今,在一项新的研究中,借助于斯坦福大学领导的一个研究团队研发的仪器与技术,其运动轨迹比以往任何时候都更加清晰。
这项技术涉及两种超敏感光学仪器,能够检测到经过基因工程改造的称为 电压指示剂(voltage indicators) 的蛋白质信号,从而揭示小鼠体内脑神经元脑电波活动。相关研究结果发表于《细胞》杂志。
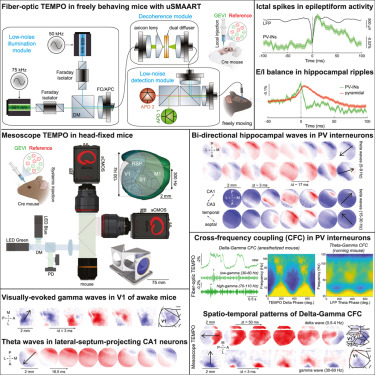
尽管目前仅限于研究动物,但这一进展已展现出其潜力。该研究团队利用这些仪器发现了三种新型脑电波,其运动方式此前从未被观察到。
论文通讯作者、斯坦福大学人文与科学学院生物学与应用物理学教授Mark J. Schnitzer说道, 我们正在获得大脑内电波传播的广泛视角。我们能够同时观察多个脑区,并看到脑电波以细胞类型特异性方式扫过大脑最外层的神经组织 皮层。
10.
DOI: 10.1016/j.cell.2025.06.026
在一项新的研究中,来自澳大利亚悉尼大学和中国北京大学等研究机构的研究人员取得了一项具有里程碑意义的发现,这可能为包括杜氏肌症、庞贝病和在内的一系列严重遗传性疾病提供更安全、更有效的基因疗法。相关研究结果发表于《细胞》杂志。
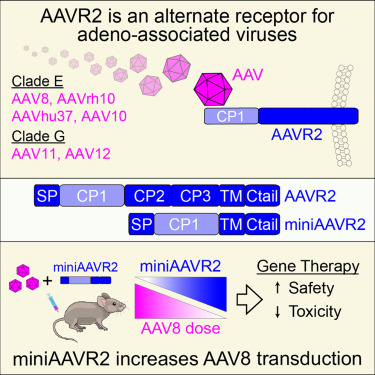
这项研究揭示了一种此前未知的进入人体细胞的通道 一种名为AAVR2的受体,基因疗法病毒正是利用该受体将治疗性基因递送至细胞内。这一新发现的通路可能使治疗过程中使用更低剂量的病毒成为可能,从而减少副作用和治疗成本,同时改善患者预后。
基因疗法通常使用经过修改的腺相关病毒(AAV),将健康基因送入体内。这类治疗方法有望为患者、其家庭和护理人员带来生活改变。然而,它们通常需要高剂量的载体才能产生治疗效果,而在某些情况下,这可能引发严重的免疫反应、导致严重并发症,甚至死亡。
我们发现,某些AAV类型可利用新发现的受体AAVR2进入细胞,为此前已知的进入途径提供了替代方案。这一发现揭示了一种将基因送入细胞的全新通路。调节这一通路可能使基因疗法更安全、更经济且更精准, 论文第一作者、悉尼大学研究员Bijay Dhungel博士说道。(100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
