Sci Adv:上海交通大学夏强等团队研究开发了一种基于mRNA的蛋白质替代疗法,用于治疗PH1
时间:2025-04-21

原发性高草酸尿症1型(PH1)是一种罕见的常染色体隐性遗传代谢性疾病,其特征是由于丙氨酸-乙醛酸氨基转移酶(AGT)酶活性缺乏导致草酸盐过量产生。这种缺乏是由AGXT基因突变引起的,会导致草酸盐在肾脏和其他组织中的积累和沉积。PH1的发病机制主要涉及由AGXT基因突变引起的多种分子缺陷,如蛋白质不稳定、聚集和消除,缺乏辅因子结合或低亲和力,以及AGT向线粒体的错误定位。值得注意的是,错误定位的AGT酶虽然保留了正常量的酶活性,但无法与其底物接触,因此其功能后果与其他导致无酶活性的致病突变相同。所有这些缺陷都会导致代谢效率低下,这对于草酸盐前体乙醛酸的解毒至关重要。临床上,PH1通常表现为复发性肾结石、肾钙质沉着症和慢性肾脏疾病,若不经治疗可能会进展为终末期肾脏疾病。在肾功能衰竭的情况下,草酸盐的持续积累还会导致严重并发症,如全身性草酸盐沉着症,其中草酸盐晶体沉积在心脏、骨骼和眼睛等多个器官中,影响患者的生活质量和预后。
早期PH1的治疗策略旨在降低肾结石的发生率并减缓疾病进展。这些策略包括保持高液体摄入量、低草酸盐饮食和使用柠檬酸盐补充剂。特定AGXT基因突变的患者可能会受益于药物治疗,如吡哆醇(维生素B6)。在一个队列中,约有30%的PH1患者具有对吡哆醇有反应的突变,而在另一个队列和前瞻性试验中,50%的患者显示出对吡哆醇的敏感性。对于患有晚期肾脏疾病的患者,需要肾脏替代疗法,包括透析,以及在必要时进行肝脏或肝肾联合移植,以恢复正常的AGT功能和实现稳定的代谢控制。
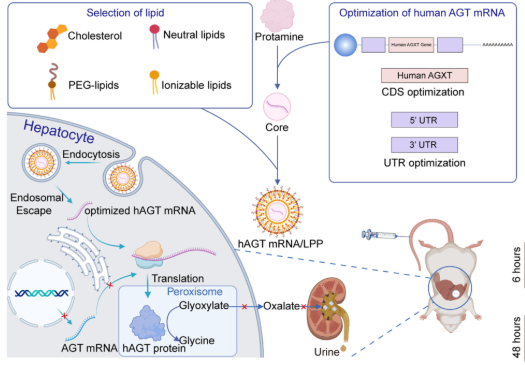
模式机理图(图片源自Science Advances)
基于RNA的疗法,如RNA干扰(RNAi),可以靶向草酸盐产生的上游(lumasiran)或下游(nedosiran)致病代谢途径。lumasiran和nedosiran这两种药物在临床试验中都显示出有希望的结果。此外,它们已分别于2020年和2023年获得美国食品和药物管理局(FDA)的批准并商业化。然而,使用RNAi的底物减少疗法可能会通过非特异性基因沉默和长期抑制正常基因表达而带来风险。这些副作用可能源于类似微RNA的脱靶效应、反义链与非靶标mRNA序列之间的不匹配,以及正义链进入RNA诱导沉默复合体(RISC)。除了RNAi疗法外,基因组编辑技术,特别是CRISPR-Cas9和CRISPR碱基编辑器,可能为治疗干预提供新的途径。近年来,通过mRNA传递的蛋白质替代疗法已成为一些单基因疾病的有效治疗方法。mRNA介导的蛋白质替代疗法已成功应用于尿素循环障碍和丙酸血症。这些创新治疗方法为PH1患者提供了更有效管理和潜在治愈方案的希望。
在这里,作者评估了一种针对PH1的mRNA替代疗法。作者使用线性设计算法结合非翻译区(UTR)优化来生成用于mRNA生产的高表达载体。为了改进mRNA的传递,作者开发了新型优化的脂质纳米颗粒,以延长体内蛋白质表达时间。在小鼠和大鼠的Agxt / 模型中,作者可以证明人AGT(hAGT)mRNA在72小时内显著抑制草酸盐分泌。为了模拟当前的临床治疗,作者将维生素B6与mRNA疗法联合使用,结果草酸盐水平迅速降低到正常值。最后,hAGT mRNA可以改善PH1患者来源的多细胞人体类器官中的肝细胞功能。
原文链接:https://doi.org/10.1126/sciadv.adt9694
