NCB:剑桥大学团队发现,一种治疗青光眼的药物可以让细胞“吐出”tau蛋白,改善小鼠认知!
时间:2024-11-27
来源:奇点糕 2024-11-27 14:01
研究发现一种治疗青光眼的药物——碳酸酐酶抑制剂——可以降低细胞tau蛋白水平。来自剑桥大学的研究团队利用转基因斑马鱼模型,对1400多种经过美国食品药品监督局()批准的药物化合物进行了筛选,发现一种治疗青光眼的药物 碳酸酐酶抑制剂 可以降低细胞tau蛋白水平。
碳酸酐酶抑制剂可以使溶酶体移动至细胞表面,促进细胞 吐出 tau蛋白,从而降低总tau水平和磷酸化tau水平。对于携带人类tau突变的小鼠模型,碳酸酐酶抑制剂治疗使小鼠大脑tau水平下降,记忆和认知能力得到提高。
研究发表在《自然 化学生物学》杂志上。

研究人员构建了具有明显tau毒性,并且适用于中等通量筛选的脊椎动物模型 转基因斑马鱼tau蛋白病变模型 在鱼视网膜中表达人类野生型tau。由于tau蛋白毒性,视网膜细胞会在几天之内迅速退化,表现为光感受器丢失和感光细胞退化,这种退化过程可以有效模拟tau病理变化。
研究人员共测试了1437种药物,以斑马鱼杆状光感受器变性改善评价tau毒性,筛选选中了methocarbamol。3 M浓度的methocarbamol可以显著挽救tau诱导的感光细胞退化、脊柱和体轴的形态缺陷,降低总tau和磷酸化tau水平。
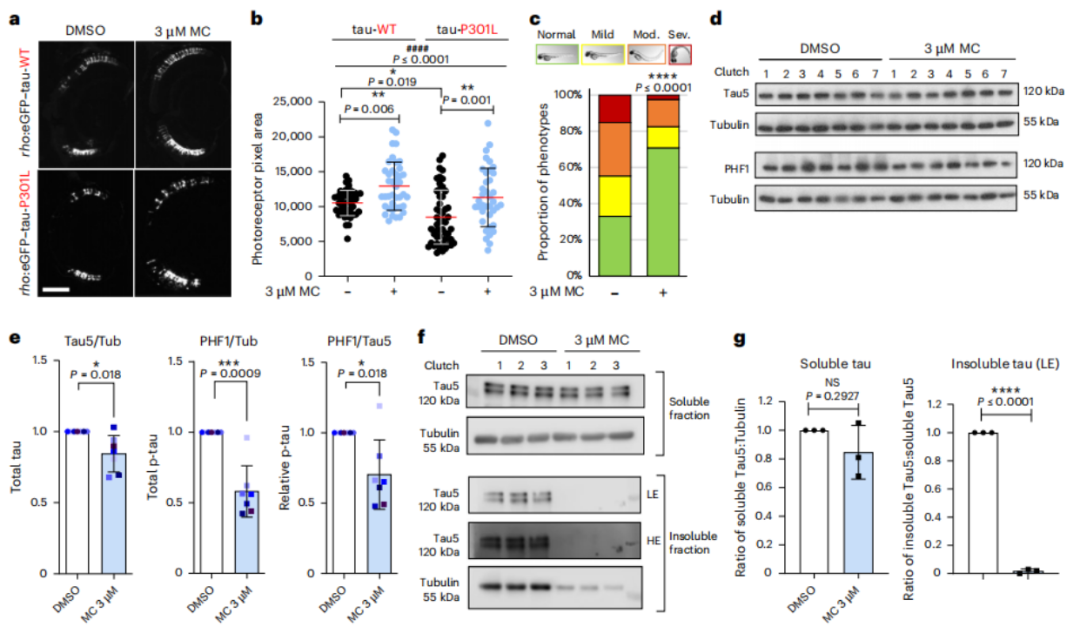
methocarbamol改善tau毒性相关病理、降低tau水平
methocarbamol是一种碳酸酐酶(CA)I抑制剂,根据药物数据库预测,会与其他CA同工酶相互作用。研究人员假设CA在methocarbamol改善tau毒性中起到关键的调节作用。通过进行RNA逆转录,研究人员找到了斑马鱼眼睛和神经元中表达CA的基因,并通过CRISPR Cas9使这些基因表达水平降低,10天后,可以观察到斑马鱼光感受器丢失和形态缺陷得到改善。也就是说,抑制CA可以预防斑马鱼模型中的tau毒性。
使用荧光信号标记神经元中的tau蛋白可以发现,抑制CA表达可以加速tau蛋白的清除速度。研究人员假设CA抑制剂是通过溶酶体清除tau的,但是在加入溶酶体抑制剂氯化铵之后,并没有阻止CA抑制剂对tau清除的加速作用。类似的实验显示,CA抑制剂对光感受器的保护作用也不依赖于自噬和蛋白酶体。
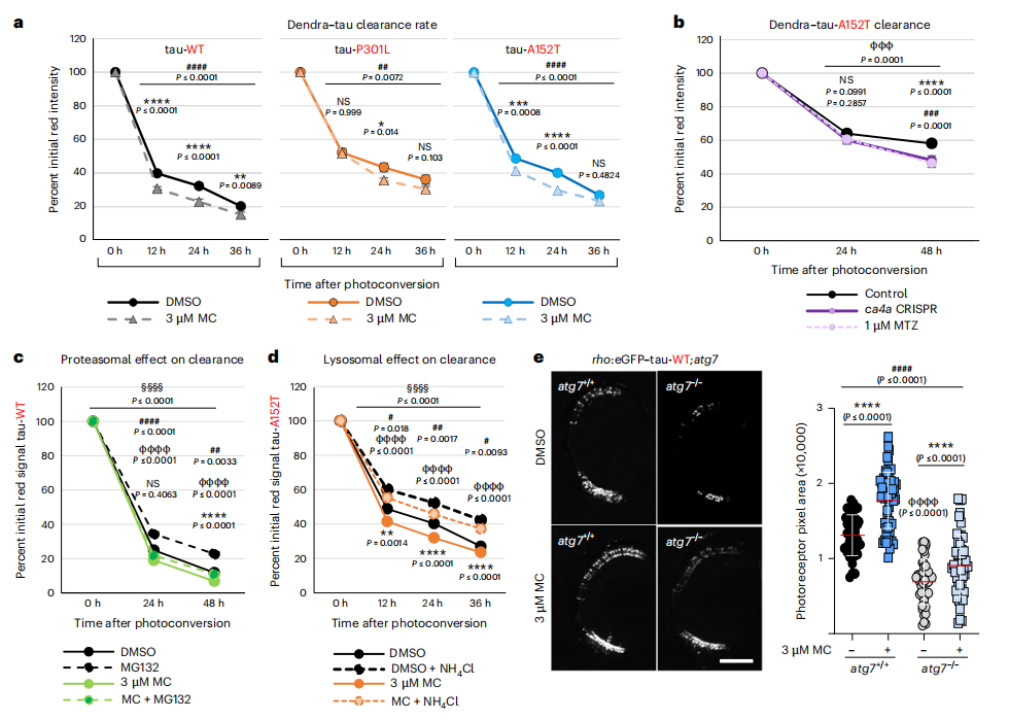
CA抑制增加tau清除率,但不会影响体内蛋白酶体或自噬降解
这就奇怪了,CA抑制剂究竟是如何促进tau清除的呢?
溶酶体除了可以降解细胞内的蛋白质,还可以将毒性蛋白通过胞吐作用排出到细胞外。通过之前的实验可知,虽然氯化铵抑制溶酶体酸化,影响溶酶体内部的降解环境,但是并没有影响tau清除,而CA抑制剂促使溶酶体的pH升高,增强了溶酶体的胞吐作用,使溶酶体移动至细胞边缘与细胞膜融合,释放tau至细胞外基质。这些被分泌出去的tau未被磷酸化,不具备引发蛋白聚集的 种子能力 ,因此可以减轻tau积累带来的细胞毒性。
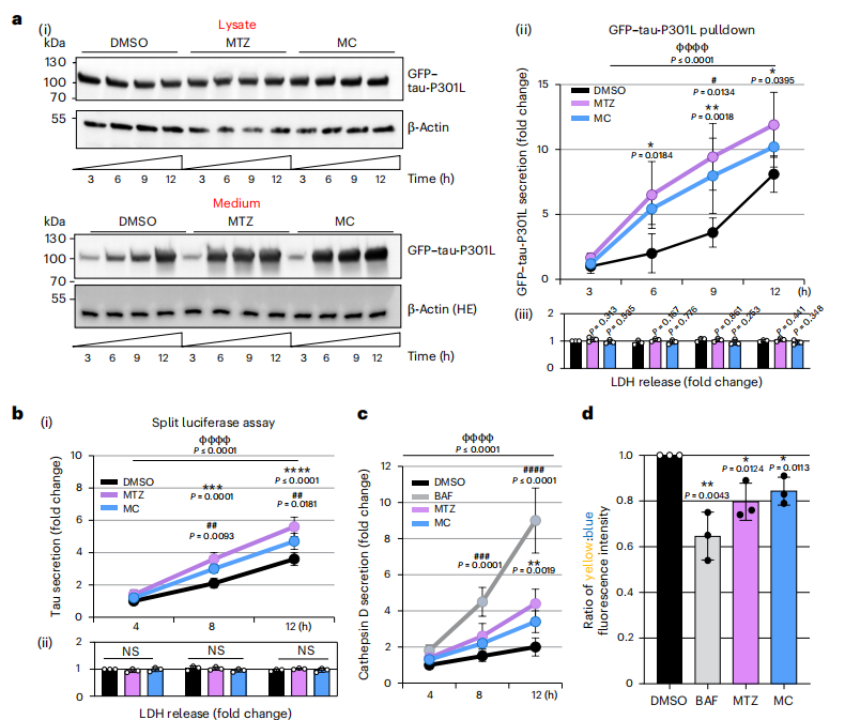
CA抑制剂通过溶酶体胞吐诱导tau分泌
接下来,研究人员在携带P301L tau突变的转基因小鼠中测试了CA抑制剂甲唑胺的效果。通过皮下植入渗透性微型泵,连续28天给药(10、20或50mg/kg/天),结果显示,低浓度甲唑胺也可以显著抑制小鼠大脑的CA活性,并且显著降低总tau-P3-1L水平;50mg/kg/天可以有效减少过度磷酸化tau水平,显著降低了毒性tau积累。
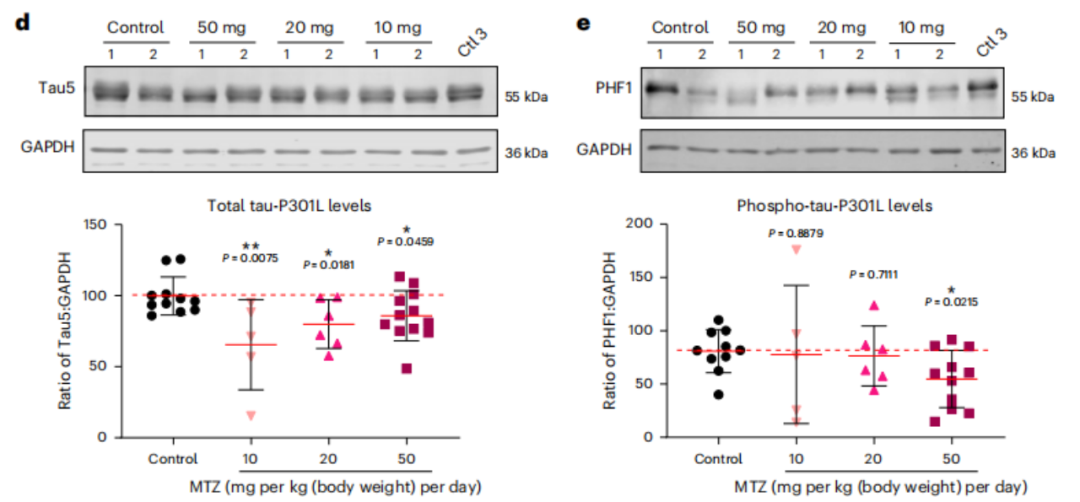
小鼠总tau和磷酸化tau水平降低
在携带P301S tau突变的PS19转基因小鼠中评估甲唑胺对认知的治疗效果。小鼠从6月龄开始逐渐形成tau聚集,在8-10月龄表现出较为严重的神经退行性症状。在小鼠8-9月龄和9-10月龄时分别植入皮下渗透性微型泵,进行每日20mg/kg甲唑胺给药,为期28天。结果显示,甲唑胺治疗显著减少了小鼠海马的神经元丢失,降低磷酸化tau积累,并且提高了小鼠对新事物的识别能力。
总的来说,研究证明CA抑制剂可以调节溶酶体酸化,促进通过胞吐作用的tau分泌,从而降低神经元内的tau水平,改善斑马鱼和小鼠模型中的神经元丢失和行为缺陷,展示了CA抑制剂用于治疗tau异常聚集为主要病理特征的神经退行性疾病的可能性,同时也说明,刺激毒性蛋白的非常规分泌可能是治疗相关疾病的有效方法。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
