Nature子刊:北京大学陈鹏团队开发相分离体系中蛋白质互作的时空特异性光交联技术
时间:2024-11-17
来源:生物世界 2024-11-17 09:39
该研究巧妙地融合了空间特异的蛋白质标记技术与凝聚增强的代谢光交联探针,开发了一种高效且普适的时空特异光交联技术——DenseMAP。近年来,生物大分子的液-液相分离(LLPS)现象及其所形成的无膜亚细胞结构 生物分子凝集体(Biomolecular condensates),已成为科研领域的热点。这些凝集体能够在不依赖膜结构的情况下,对生物大分子进行空间分隔,从而实现对细胞生理过程的时空调控。其中,蛋白质-蛋白质相互作用(PPI)是这一调控机制的重要基础。因此,深入解析特定生物分子凝集体中的蛋白质互作,对于揭示其形成机制与功能具有重要意义。
然而,由于生物分子凝集体的动态形成过程及缺乏清晰膜结构边界的特性,传统物理分离、共沉淀等方法难以有效保留其互作信息。同时,其内部结构的复杂性和拥挤性,使得基于可扩散探针的邻近标记方法易产生较多假阳性结果。带有光交联基团的非天然氨基酸能在蛋白质翻译过程中被整合进感兴趣的蛋白质(POI)中,并在光激发后产生固定在蛋白质上的活性中间体,从而实现高度时空特异性的交联,广泛应用于捕获活细胞中的直接和瞬时PPI。其中,可代谢插入的光交联氨基酸作为天然氨基酸的类似物,能够通过细胞代谢通路全局性引入整个蛋白质组中相应氨基酸位点,实现多点插入,在捕获LLPS体系中的多价相互作用时具有优势。
2024年11月5日,北京大学陈鹏教授课题组在NatureChemistry期刊发表了题为:Spatiotemporal protein interactome profiling through condensation-enhanced photocrosslinking的研究论文。
该研究报道了一种时空特异的蛋白质光交联技术 DenseMAP(Condensation-enhanced Spatial-directed Metabolic Incorporation-Assisted Photo-crosslinking),通过将空间特异的蛋白质标记与凝聚增强的光交联相结合,对活细胞中特定生物分子凝集体的蛋白质相互作用进行了高效捕捉和鉴定。

首先,研究团队利用手段分析了20种氨基酸在生物分子凝集体蛋白质组中的分布,发现赖氨酸丰度较高,且由于残基带正电,较多地分布于蛋白质互作界面,基于此他们开发出 位带有光交联基团双吖丙啶(diazirine)的新型光交联赖氨酸( -photo-lysine, K*)。与此前报道的 位带有光交联基团的光交联赖氨酸相比,新型探针更易合成,光交联的效率更高。他们还验证了插入 K*后对细胞正常生理状态和蛋白质功能的影响很小,之后又通过1,6己二醇处理以及相分离功能失活突变体的交联实验证明,基于纳米级的交联半径以及多位点插入的特性, K*在拥挤的相分离体系中具有更高的交联效率,实现了一种 凝聚增强 的效应。
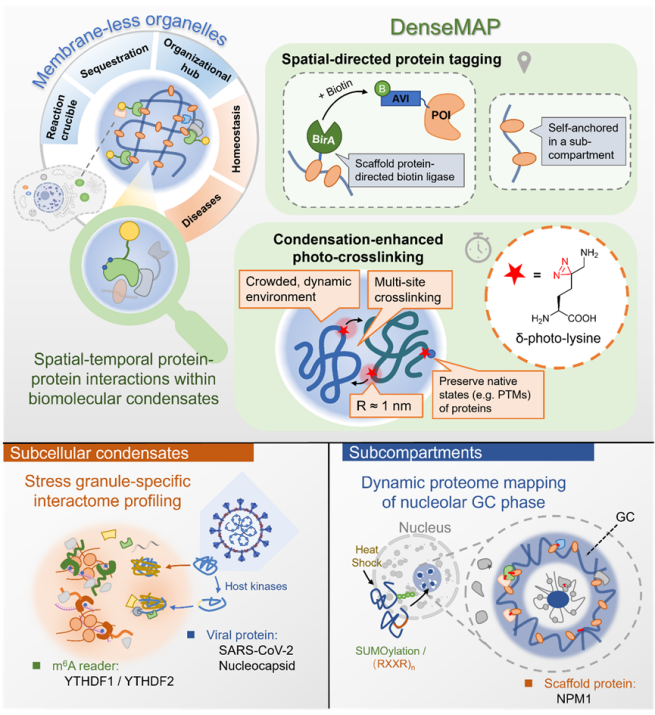
DenseMAP策略及其生物学应用示意图
由于生物分子凝集体有着复杂的组织结构,其中的蛋白质也可大致分为两类,分别是 客户 蛋白(clientprotein)和 骨架 蛋白(scaffoldprotein),前者一般同时分布在多个亚细胞区域,仅在特定条件下进入动态形成的生物分子凝集体中;而后者则介导了特定生物分子凝集体的形成,往往具有单一的空间定位,其多价相互作用普遍覆盖了其中的 客户 蛋白。因此,对于不同类型的蛋白质,研究团队设计了两种DenseMAP的应用路线。
对于同时具有多个定位的 客户 蛋白(client),研究团队通过偶联生物素连接酶(BirA)的特定生物分子凝集体的 骨架 蛋白对其进行标记,与DenseMAP的凝聚增强交联相互配合,能够特异地捕捉位于感兴趣的生物分子凝集体内的POI的互作蛋白质组。根据这一思路,利用G3BP1-BirA结合 K*,捕捉和鉴定了应激颗粒(SG)中SARS-CoV-2的核衣壳(N)蛋白的互作蛋白质组,并解析了宿主激酶介导的磷酸化对N蛋白在SG中与许多功能性RNA结合蛋白互作的促进作用,进一步阐释了病毒与宿主相互拮抗过程的机制。他们也鉴定和比较了m6A修饰的 阅读器 YTHDF1、YTHDF2在SG中的互作蛋白质组,验证了此前对于二者在SG形成过程中具有不同性质的结论。
另一方面,由于许多生物分子凝集体展现出复杂的 亚区域 (Subcompartment)结构,往往每一个亚区域通过特定的 骨架 蛋白来维持结构并招募 客户 蛋白,进而实现物质的动态交换。然而,由于结构上的紧密交织,这些亚区域的蛋白质组很难通过传统的物理分离或邻近标记手段精确地区分与鉴定。值得注意的是,对于单一定位的 骨架 蛋白,无需额外引入标记手段即可获得其在特定亚区域的直接互作蛋白,这类蛋白质因其对区域内 客户 蛋白的广泛直接相互作用,使得其互作组实际上可以看作是该亚区域蛋白质组的一个缩影。基于此,利用DenseMAP策略来获取 骨架 蛋白的互作组,为深入研究生物分子凝集体中特定亚区域的性质提供了新的视角。
此前研究表明,核仁最外侧的颗粒组分(granular component,GC)层在压力条件下能够储存细胞核内的错误折叠蛋白质,从而保护细胞维持正常功能,在蛋白质质量控制(PQC)中扮演着关键角色。为了进一步探索这一机制,研究团队运用DenseMAP策略,捕捉并鉴定了在正常生理条件以及热刺激条件下,GC层中 骨架 蛋白NPM1的互作组,发现热刺激后,GC亚层蛋白质组中SUMO化修饰的蛋白质含量显著增加。经过一系列生物学验证,研究团队揭示了SUMO化修饰,尤其是SUMO2/3,能够通过其序列上的R-motif与NPM1相结合,进而招募那些本身不含有R-motif的错误折叠蛋白进入核仁进行暂时储存。这一发现不仅为核仁在PQC中的机制提供了重要的补充,同时也为理解渐冻症(ALS)等神经退行性疾病的发病机理,以及探索潜在的治疗策略提供了新的线索和依据。
综上所述,该研究巧妙地融合了空间特异的蛋白质标记技术与凝聚增强的代谢光交联探针,开发了一种高效且普适的时空特异光交联技术 DenseMAP。这一策略能够精准地捕捉和鉴定活细胞中特定生物分子凝集体内蛋白质的相互作用,为深入阐释无膜细胞器的功能机制、动态变化过程和疾病相关机理提供了强有力的工具。
北京大学化学与分子工程学院陈鹏教授为本文的通讯作者,博士毕业生李可心、谢肖、高瑞为论文共同第一作者。此外,北京大学基础医学院李婷婷教授及博士毕业生陈钊铭在生物信息学方面做出了重要贡献。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
